题目内容
7.在一容积为2L的密闭容器中加入2molA和3molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)?3C(g),达到平衡后生成1.5molC,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2mol.
请回答下列问题,
(1)该反应的焓变△H<0(填“>”、“<”或“=”).
(2)30℃时,平衡混合气中C的体积分数ω=30%,A物质的转化率与B物质的转化率之比为3:4.
(3)30℃时,若在同一容器中加入1.5mol A、2 mol B和1.5mol C,则平衡混合气中C的体积分数仍为ω,此时平衡体系中A的物质的量浓度为0.75mol•L-1.
分析 (1)由题意可知,升高温度平衡时C的物质的量减小,说明升高温度平衡逆向移动,故正反应为放热反应;
(2)反应前后气体总物质的量不变,30℃达到平衡后生成1.5molC,C的体积分数=$\frac{c的物质的量}{混合气体总物质的量}$×100%;根据方程式计算消耗A、B物质的量,再计算转化率之比;
(3)30℃时,改变起始物质通入量,到达平衡混合气中C的体积分数仍为ω,说明与原平衡为等效平衡,反应前后气体体积不变,按化学计量数比转化到左边满足n(A):n(B)=2:3;
与30℃到达平衡为完全等效平衡,平衡时A的浓度相等;
解答 解:(1)由题意可知,升高温度平衡时C的物质的量减小,说明升高温度平衡逆向移动,故正反应为放热反应,则△H<0,故答案为:<;
(2)反应前后气体总物质的量不变,30℃达到平衡后生成1.5molC,C的体积分数=$\frac{1.5mol}{2mol+3mol}$×100%=30%;
根据方程式计算消耗A为1.5mol×$\frac{1}{3}$=0.5mol、消耗B物质的量为1.5mol×$\frac{2}{3}$=1mol,A物质的转化率与B物质的转化率之比为$\frac{0.5mol}{2mol}$:$\frac{1mol}{3mol}$=3:4,
故答案为:30%;3:4;
(3)30℃时,改变起始物质通入量,到达平衡混合气中C的体积分数仍为ω,说明与原平衡为等效平衡,反应前后气体体积不变,按化学计量数比转化到左边满足n(A):n(B)=2:3,则(1.5mol+1.5mol×$\frac{1}{3}$):[n(B)+1.5mol×$\frac{2}{3}$]=2:3,解得n(B)=2;
与30℃到达平衡为完全等效平衡,平衡时A的浓度相等,则平衡时A的物质的量为$\frac{2mol-0.5mol}{2L}$=0.75mol/L,
故答案为:2;0.75.
点评 本题考查化学平衡计算与影响因素,(3)中关键是对等效平衡规律的理解掌握,难度中等.

| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸钡溶于稀硝酸:BaCO3+2H+=Ba2++CO2↑+H2O | |
| C. | 实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O | |
| D. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ |
| 相对分 子质量 | 密度 (g•cm-3) | 沸点 ℃ | 溶解性 | |
| 环己 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
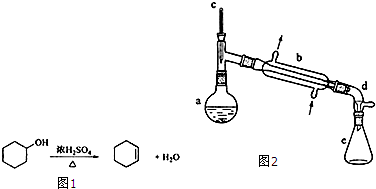
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是D(填正确答案标号).
A.立即补加B.重新配料C.不需补加 D.冷却后补加
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C(填正确答案标号).
A.蒸馏烧瓶B.温度计C.分液漏斗D.冷凝管E.接收器
CO2(g)+H2(g)?CO(g)+H2O(g)△H=Q kJ•mol-1
测得其化学平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 |
| K | 0.6 | 0.9 | 1.0 |
①上述反应中Q>0 (选填“>”或“<”或“=”).
②在恒温下,能判断该反应已达到化学平衡状态的依据是cd.
a.容器中压强不变
b.该反应的反应热△H不变
c.H2的质量分数不再变化
d.单位时间内生成H2O的物质的量与生成CO2的物质的量相等
(2)850℃时,向2L的密闭容器中通入1mol CO 和 m mol H2O,当反应达到平衡时,平衡混合物中n(H2O)=2n(H2),则m=2.
(3)850℃时,向2L的密闭容器中通入2mol CO 和 4mol H2O,当反应达到平衡时,n (H2)=$\frac{4}{3}$.
(4)850℃时,向2L的密闭容器中通入a mol CO、b mol H2O、c mol CO2和d molH2.
①若要求反应达到平衡时H2的物质的量分数与(3)的相同,则a、b、c、d之间应满足的关系是:(a+c):(b+d)=1:2,且c=d.
②若要求反应向生成H2的方向进行,则a、b、c、d之间应满足的关系是:ab>cd.
| A. | 探究Na与水反应可能有O2生成 | |
| B. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| C. | 探究NO2被NaOH溶液吸收可能生成NaNO3 | |
| D. | 探究FeCl3与KI溶液的反应可能是可逆反应 |
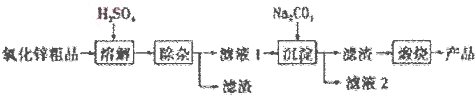
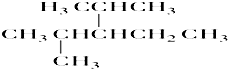 .
.