题目内容
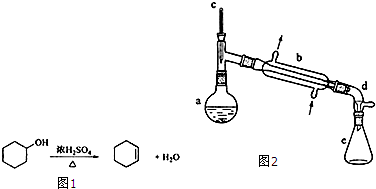
10.Na2S2O3可以用作氰化物的解毒剂,工业上常用硫化碱法制备Na2S2O3,反应原理为:2Na2S+Na2CO3+4SO23Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,实验装置如图1:
Ⅰ.实验步骤:
(1)检查装置气密性,按如图示加入试剂.仪器a的名称是分液漏斗;
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4.
(3)待Na2S和Na2CO3完全消耗后,结束反应.过滤C中混合物,滤液经蒸发浓缩、冷却结晶(填写操作名称)、过滤、洗涤、干燥,得到产品.
Ⅱ.[探究与反思]
(1)装置D的作用是检验装置C中SO2的吸收效率,则D中试剂是品红或溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是D中溶液颜色很快褪去.
(2)实验制得的Na2S2O3•5H2O样品中可能含有Na2SO3、Na2SO4等杂质.利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质.
已知Na2S2O3•5H2O遇酸易分解:S2O32?+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
(3)为减少装置A中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液.
Ⅲ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0mol•L-1碘的标准溶液滴定.
反应原理为2S2O32?+I2═S4O62?+2I-
(1)滴定至终点时,溶液颜色的变化:溶液由无色变为蓝色.
(2)滴定起始和终点的液面位置如图2,则消耗碘的标准溶液体积为18.10mL.产品的纯度为(设Na2S2O3•5H2O相对分子质量为M)$\frac{3.62×10{\;}^{-3}M}{W}$×100%.
分析 Ⅰ.(1)根据装置可知仪器a的名称;
(3)根据从Na2S2O3溶液中将Na2S2O3结晶析出的操作分析;
Ⅱ.(1)检验装置C中SO2的吸收效率的高低影响着D装置中SO2的量,检验SO2可以用品红或溴水或KMnO4溶液,SO2吸收效率低时,D装置中SO2量就多,据此判断;
(2)检验硫酸根离子可以在酸性溶液中加钡离子,看是否有沉淀出现;
(3)根据亚硫酸钠易被氧化生成硫酸钠分析;
Ⅲ.(1)Na2S2O3反应完毕,加入最后一滴碘的标准液遇淀粉变蓝色;
(2)起始、终点时标准液读数之差消耗标准液的体积;根据方程式计算Na2S2O3的物质的量,再根据m=nM计算其质量,进而计算产品的纯度.
解答 Ⅰ.(1)根据装置可知仪器a的名称为分液漏斗,
故答案为:分液漏斗;
(3)过滤C中混合物,滤液Na2S2O3溶液,将Na2S2O3溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到a2S2O3晶体,
故答案为:蒸发浓缩、冷却结晶;
Ⅱ.(1)检验装置C中SO2的吸收效率的高低影响着D装置中SO2的量,检验SO2可以用品红或溴水或KMnO4溶液,SO2吸收效率低时,D装置中SO2量就多,所以D中的试剂为品红或溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是D中溶液颜色很快褪去,
故答案为:品红或溴水或KMnO4溶液;颜色很快褪去;
(2)检验硫酸根离子可以在酸性溶液中加钡离子,其操作为取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(3)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,
故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;
Ⅲ.(1)Na2S2O3反应完毕,加入最后一滴碘的标准液遇淀粉变蓝色,滴定至终点时,溶液颜色的变化是:溶液由无色变为蓝色,
故答案为:溶液由无色变为蓝色;
(2)由图可知,开始液面读数为0.00mL,滴定终点液面读数为18.10mL,则消耗标准液的体积为18.10mL,由2S2O32-+I2=S2O32-+2I-可知n(Na2S2O3)=2n(I2)=2×18.10×10-3L×0.1mol/L=)=3.62×10-3mol,故样品的纯度为$\frac{3.62×10{\;}^{-3}mol×Mg/mol}{Wg}$×100%=$\frac{3.62×10{\;}^{-3}M}{W}$×100%,
故答案为:18.10;$\frac{3.62×10{\;}^{-3}M}{W}$×100%.
点评 本题考查实验制备方案、物质含量的测定,明确原理是解题关键,注意对题目信息的提取应用,是对学生综合能力的考查,难度中等.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑ | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | CaO+H2O═Ca(OH)2 |
| 相对分 子质量 | 密度 (g•cm-3) | 沸点 ℃ | 溶解性 | |
| 环己 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是D(填正确答案标号).
A.立即补加B.重新配料C.不需补加 D.冷却后补加
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C(填正确答案标号).
A.蒸馏烧瓶B.温度计C.分液漏斗D.冷凝管E.接收器
CO2(g)+H2(g)?CO(g)+H2O(g)△H=Q kJ•mol-1
测得其化学平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 |
| K | 0.6 | 0.9 | 1.0 |
①上述反应中Q>0 (选填“>”或“<”或“=”).
②在恒温下,能判断该反应已达到化学平衡状态的依据是cd.
a.容器中压强不变
b.该反应的反应热△H不变
c.H2的质量分数不再变化
d.单位时间内生成H2O的物质的量与生成CO2的物质的量相等
(2)850℃时,向2L的密闭容器中通入1mol CO 和 m mol H2O,当反应达到平衡时,平衡混合物中n(H2O)=2n(H2),则m=2.
(3)850℃时,向2L的密闭容器中通入2mol CO 和 4mol H2O,当反应达到平衡时,n (H2)=$\frac{4}{3}$.
(4)850℃时,向2L的密闭容器中通入a mol CO、b mol H2O、c mol CO2和d molH2.
①若要求反应达到平衡时H2的物质的量分数与(3)的相同,则a、b、c、d之间应满足的关系是:(a+c):(b+d)=1:2,且c=d.
②若要求反应向生成H2的方向进行,则a、b、c、d之间应满足的关系是:ab>cd.
| A. | 探究Na与水反应可能有O2生成 | |
| B. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| C. | 探究NO2被NaOH溶液吸收可能生成NaNO3 | |
| D. | 探究FeCl3与KI溶液的反应可能是可逆反应 |
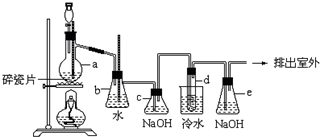 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用如图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水).
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用如图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水).
 .
.
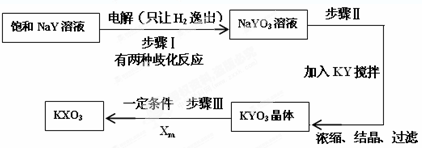
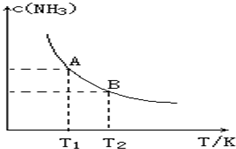 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.