题目内容
4.已知8NH3+3Cl2=6NH4Cl+N2反应中电子转移数为1.806×1023,则被氧化的物质的体积是22.4L(标准状况)分析 反应8NH3+3Cl2═6NH4Cl+N2,N元素的化合价升高,Cl元素的化合价降低,该反应中转移6e-,以此来解答.
解答 解:反应8NH3+3Cl2═6NH4Cl+N2,N元素的化合价升高,Cl元素的化合价降低,生成1mol氮气有2molNH3被氧化转移6mol电子,则当反应中转移1.806×1024个电子时,被氧化的气体体积为$\frac{1.806×1{0}^{24}}{6.03×1{0}^{23}}$×$\frac{1}{6}$mol×2×22.4L/mol=22.4L,
故答案为:22.4.
点评 本题考查氧化还原反应,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
15.相同温度下两种H3PO4溶液a和b浓度分别为0.3mol/L和0.1mol/L,则a和b溶液中H+浓度之比为( )
| A. | 3 | B. | 大于3 | C. | 小于3 | D. | 不能确定 |
12.在下列反应中水只起还原剂作用的是( )
| A. | 2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑ | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | CaO+H2O═Ca(OH)2 |
19.把7.4g Na2CO3•10H2O和NaHCO3组成的混合物完全溶解于水配成100mL溶液,其中c(Na+)=0.6mol/L.向溶液中加入足量的盐酸充分反应,将溶液蒸干后,所得固体质量是( )
| A. | 2.12g | B. | 3.51g | C. | 4.22g | D. | 5.28g |
9.下列离子方程式书写正确的是( )
| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸钡溶于稀硝酸:BaCO3+2H+=Ba2++CO2↑+H2O | |
| C. | 实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O | |
| D. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ |
16.下列事实没有涉及可逆反应的是( )
| A. | 工业上合成氨的原理 | |
| B. | 工业上产生硫酸 | |
| C. | 热的纯碱溶液洗涤效果更好 | |
| D. | 受热时,试管底部的NH4Cl部分转移至试管上端 |
2.将1molH2与2mol CO2的混合气体通入容积为2L的密闭容器中,发生如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g)△H=Q kJ•mol-1
测得其化学平衡常数K和温度t的关系如下:
(1)请回答:
①上述反应中Q>0 (选填“>”或“<”或“=”).
②在恒温下,能判断该反应已达到化学平衡状态的依据是cd.
a.容器中压强不变
b.该反应的反应热△H不变
c.H2的质量分数不再变化
d.单位时间内生成H2O的物质的量与生成CO2的物质的量相等
(2)850℃时,向2L的密闭容器中通入1mol CO 和 m mol H2O,当反应达到平衡时,平衡混合物中n(H2O)=2n(H2),则m=2.
(3)850℃时,向2L的密闭容器中通入2mol CO 和 4mol H2O,当反应达到平衡时,n (H2)=$\frac{4}{3}$.
(4)850℃时,向2L的密闭容器中通入a mol CO、b mol H2O、c mol CO2和d molH2.
①若要求反应达到平衡时H2的物质的量分数与(3)的相同,则a、b、c、d之间应满足的关系是:(a+c):(b+d)=1:2,且c=d.
②若要求反应向生成H2的方向进行,则a、b、c、d之间应满足的关系是:ab>cd.
CO2(g)+H2(g)?CO(g)+H2O(g)△H=Q kJ•mol-1
测得其化学平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 |
| K | 0.6 | 0.9 | 1.0 |
①上述反应中Q>0 (选填“>”或“<”或“=”).
②在恒温下,能判断该反应已达到化学平衡状态的依据是cd.
a.容器中压强不变
b.该反应的反应热△H不变
c.H2的质量分数不再变化
d.单位时间内生成H2O的物质的量与生成CO2的物质的量相等
(2)850℃时,向2L的密闭容器中通入1mol CO 和 m mol H2O,当反应达到平衡时,平衡混合物中n(H2O)=2n(H2),则m=2.
(3)850℃时,向2L的密闭容器中通入2mol CO 和 4mol H2O,当反应达到平衡时,n (H2)=$\frac{4}{3}$.
(4)850℃时,向2L的密闭容器中通入a mol CO、b mol H2O、c mol CO2和d molH2.
①若要求反应达到平衡时H2的物质的量分数与(3)的相同,则a、b、c、d之间应满足的关系是:(a+c):(b+d)=1:2,且c=d.
②若要求反应向生成H2的方向进行,则a、b、c、d之间应满足的关系是:ab>cd.
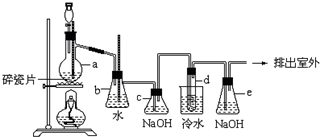 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用如图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水).
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用如图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水).