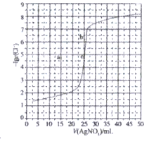
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΡ≥Βγ¬ΖΑε…ζ≤ζΤσ“ΒΒΡΥ°÷ «ιΩωΦΑΙζΦ“‘ –μ≈≈Ζ≈ΒΡΈέΥ°±ξΉΦ»γœ¬±μΥυ ΨΓΘΈΣ―–ΨΩΖœΥ°÷–Cu2+¥ΠάμΒΡΉνΦ―pHΘ§»Γ5ΖίΒ»ΝΩΒΡΖœΥ°Θ§Ζ÷±π”Ο30%ΒΡNaOH»ή“ΚΒςΫΎpH÷Ν8.5ΓΔ9ΓΔ9.5ΓΔ10ΓΔ11Θ§Ψ≤÷ΟΚσΘ§Ζ÷Έω…œ≤ψ«ε“Κ÷–Ά≠‘ΣΥΊΒΡΚ§ΝΩΘ§ Β―ιΫαΙϊ»γœ¬ΆΦΥυ ΨΓΘ≤ι‘ΡΉ ΝœΘΚ
ΤΫΚβΔώΘΚ![]()
ΤΫΚβΔρΘΚ![]()
œνΡΩ | ΖœΥ°Υ°÷ | ≈≈Ζ≈±ξΉΦ |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | Γή0.5 |
NH4+/mgL-1 | 2632 | Γή15 |
œ¬Ν–ΥΒΖ®¥μΈσΒΡ «Θ® Θ©
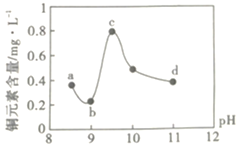
A.a~bΕΈΖΔ…ζΒΡΖ¥”ΠΈΣΘΚ![]()
B.b~cΕΈΘΚΥφpH…ΐΗΏΘ§Cu(OH)2ΒΡΝΩ‘ωΦ”Θ§ΒΦ÷¬ΤΫΚβΔώ’ΐœρ“ΤΕ·Θ§Ά≠‘ΣΥΊΚ§ΝΩ…œ…ΐ
C.c~dΕΈΘΚΥφpH…ΐΗΏΘ§c(OH-)‘ωΦ”Θ§ΤΫΚβΔώΡφœρ“ΤΕ·Θ§Ά≠‘ΣΥΊΚ§ΝΩœ¬ΫΒ
D.dΒψ“‘ΚσΘ§Υφc(OH-)‘ωΦ”Θ§Ά≠‘ΣΥΊΚ§ΝΩΩ…Ρή…œ…ΐ
ΓΨ¥πΑΗΓΩB
ΓΨΫβΈωΓΩ
A. a~bΕΈΆ≠‘ΣΥΊΚ§ΝΩΦθ–ΓΘ§–Έ≥…Cu(OH)2≥ΝΒμΘΜ
B. ΙΧΧεΒΡΝΩ‘ωΦ”Θ§≤Μ”ΑœλΤΫΚβΒΡ“ΤΕ·ΘΜ
C. ΫαΚœ≈®Ε»Ε‘ΤΫΚβ“ΤΕ·ΒΡ”ΑœλΖ÷ΈωΘΜ
D. ΫαΚœc(OH-)Ε‘ΤΫΚβIIΒΡ”ΑœλΖ÷ΈωΓΘ
A. a~bΕΈΆ≠‘ΣΥΊΚ§ΝΩΦθ–ΓΘ§–Έ≥…Cu(OH)2≥ΝΒμΘ§“ρ¥ΥΖΔ…ζΒΡΖ¥”ΠΈΣ![]() Θ§Aœν’ΐ»ΖΘ§≤ΜΖϊΚœΧβ“βΘΜ
Θ§Aœν’ΐ»ΖΘ§≤ΜΖϊΚœΧβ“βΘΜ
B. b~cΕΈΘ§ΥφΉ≈c(OH-)‘ω¥σΘ§NH4+”κOH-ΫαΚœ…ζ≥…NH3H2OΘ§Α±Τχ≈®Ε»‘ω¥σΘ§![]() Θ§ΤΫΚβ’ΐœρΫχ––Θ§»ή“Κ÷–[Cu(NH3)4]2+≈®Ε»‘ω¥σΘ§Bœν¥μΈσΘ§ΖϊΚœΧβ“βΘΜ
Θ§ΤΫΚβ’ΐœρΫχ––Θ§»ή“Κ÷–[Cu(NH3)4]2+≈®Ε»‘ω¥σΘ§Bœν¥μΈσΘ§ΖϊΚœΧβ“βΘΜ
C. c~dΕΈΘ§Υφc(OH-)‘ωΦ”![]() ΡφœρΫχ––Θ§c(Cu2+)Φθ–ΓΘ§Ά≠‘ΣΥΊΚ§ΝΩΫΒΒΆΘ§Cœν’ΐ»ΖΘ§≤ΜΖϊΚœΧβ“βΘΜ
ΡφœρΫχ––Θ§c(Cu2+)Φθ–ΓΘ§Ά≠‘ΣΥΊΚ§ΝΩΫΒΒΆΘ§Cœν’ΐ»ΖΘ§≤ΜΖϊΚœΧβ“βΘΜ
D. dΒψ“‘ΚσΘ§Υφc(OH-)‘ωΦ”Θ§![]() ’ΐœρΫχ––Θ§…œ≤ψ«ε“Κ÷–Ά≠‘ΣΥΊΒΡΚ§ΝΩ…œ…ΐΘ§Dœν’ΐ»ΖΘ§≤ΜΖϊΚœΧβ“βΘΜ
’ΐœρΫχ––Θ§…œ≤ψ«ε“Κ÷–Ά≠‘ΣΥΊΒΡΚ§ΝΩ…œ…ΐΘ§Dœν’ΐ»ΖΘ§≤ΜΖϊΚœΧβ“βΘΜ
¥πΑΗ―ΓBΓΘ

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩΡ≥Βγ¬ΖΑε…ζ≤ζΤσ“ΒΒΡΥ°÷ «ιΩωΦΑΙζΦ“‘ –μ≈≈Ζ≈ΒΡΈέΥ°±ξΉΦ»γœ¬±μΥυ ΨΓΘΈΣ―–ΨΩΖœΥ°÷–Cu2+¥ΠάμΒΡΉνΦ―pHΘ§»Γ5ΖίΒ»ΝΩΒΡΖœΥ°Θ§Ζ÷±π”Ο30%ΒΡNaOH»ή“ΚΒςΫΎpH÷Ν8.5ΓΔ9ΓΔ9.5ΓΔ10ΓΔ11Θ§Ψ≤÷ΟΚσΘ§Ζ÷Έω…œ≤ψ«ε“Κ÷–Ά≠‘ΣΥΊΒΡΚ§ΝΩΘ§ Β―ιΫαΙϊ»γœ¬ΆΦΥυ ΨΓΘ≤ι‘ΡΉ ΝœΘΚ
ΤΫΚβΔώΘΚ![]()
ΤΫΚβΔρΘΚ![]()
œνΡΩ | ΖœΥ°Υ°÷ | ≈≈Ζ≈±ξΉΦ |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | Γή0.5 |
NH4+/mgL-1 | 2632 | Γή15 |
œ¬Ν–ΥΒΖ®¥μΈσΒΡ «Θ® Θ©
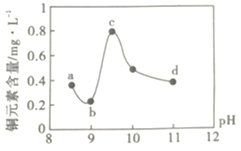
A.a~bΕΈΖΔ…ζΒΡΖ¥”ΠΈΣΘΚ![]()
B.b~cΕΈΘΚΥφpH…ΐΗΏΘ§Cu(OH)2ΒΡΝΩ‘ωΦ”Θ§ΒΦ÷¬ΤΫΚβΔώ’ΐœρ“ΤΕ·Θ§Ά≠‘ΣΥΊΚ§ΝΩ…œ…ΐ
C.c~dΕΈΘΚΥφpH…ΐΗΏΘ§c(OH-)‘ωΦ”Θ§ΤΫΚβΔώΡφœρ“ΤΕ·Θ§Ά≠‘ΣΥΊΚ§ΝΩœ¬ΫΒ
D.dΒψ“‘ΚσΘ§Υφc(OH-)‘ωΦ”Θ§Ά≠‘ΣΥΊΚ§ΝΩΩ…Ρή…œ…ΐ