题目内容
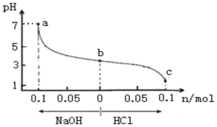
【题目】用0.100molL-1AgNO3滴定500mL0.0500molL-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )
A.曲线上各点的溶液满足关系式c(Ag+)c(Cl-)= Ksp(AgCl)
B.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
C.相同实验条件下,若改为0.0500molL-1Br-,反应终点c向b方向移动
D.相同实验条件下,若改为0.0400molL-1Cl-,反应终点c移到a
【答案】D
【解析】
A. 曲线上的点是达到沉淀溶解平衡的平衡点,满足c(Ag+)c(Cl-)= Ksp(AgCl);
B. 沉淀滴定时到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处-lgc(Cl-)=5,据此计算;
C. AgBr比AgCl更难溶,达到沉淀溶解平衡时Br-的浓度更低;
D.溶度积常数只与温度有关,改变溶液的浓度,溶度积不变。
A. 曲线上的点是达到沉淀溶解平衡的平衡点,满足Qc=c(Ag+)c(Cl-)= Ksp(AgCl),A项正确,不符合题意;
B. 沉淀滴定时到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处-lgc(Cl-)=5, 达到沉淀溶解平衡时,c(Ag+)=c(Cl-)=10-5mol/L,所以根据曲线数据可知Ksp(AgCl)的数量级为10-10,B项正确,不符合题意;
C. AgBr比AgCl更难溶,达到沉淀溶解平衡时Br-的浓度更低,即-lgc(Br-)值更大,消耗AgNO3溶液的体积不变,反应终点c向b移动,C项正确,不符合题意;
D. 溶度积常数只与温度有关,改变溶液的浓度,溶度积不变,所以相同实验条件下,若改为0.0400molL-1Cl-,所需AgNO3溶液的体积变为![]() =20mL,反应终点c移动到体积为20mL的位置,D项错误,符合题意;
=20mL,反应终点c移动到体积为20mL的位置,D项错误,符合题意;
答案选D。

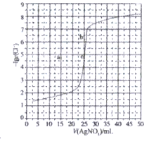
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:![]()
平衡Ⅱ:![]()
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ≤0.5 |
NH4+/mgL-1 | 2632 | ≤15 |
下列说法错误的是( )
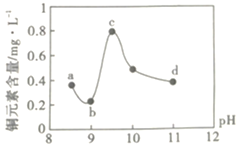
A.a~b段发生的反应为:![]()
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升