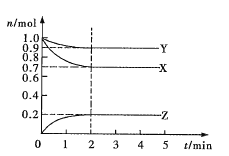
题目内容
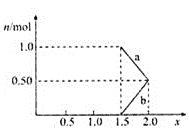
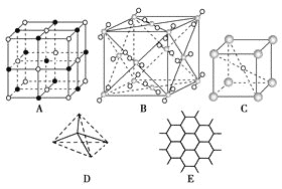
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
【答案】B
【解析】A、a点所得溶液中对H2A有:K1=c(H+)c(HA-)/c(H2A),10-1.85=10-1.85×c(HA-)/c(H2A)可得HA-与H2A的浓度相等,当V0=10mL时,生成的NaHA和剩余的H2A的物质的量相等,a点溶液显酸性,H2A的电离程度大于HA-的水解程度,故V0=10mL时混合溶液中的HA-和H2A的浓度不会相等,V0<10mL时才可能相等,A错误;B、C点所得溶液中:对HA-有K2=c(H+)xc(A2-)/c(HA-),10-7.19=10-7.19×c(A2-)/c(HA-)解得A2- 的浓度与HA-的浓度相等,B正确;C、b点加入的NaOH溶液体积为20mL,NaOH与H2A恰好完全反应生成NaHA,根据质子守恒有:c(H2A)+c(H+)=c(A2-)+ c(OH-),C错误;D、d点加入的NaOH的物质的量为H2A的物质的量的2倍,恰好生成Na2A,此时A2-第一步水解生成HA-,第一步水解的常数与H2A的第二电离常数的乘积为水的离子积常数,故第一步水解常数K1=1.0×10-14÷10-7.19=10-6.81,D错误。正确答案为B。

【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
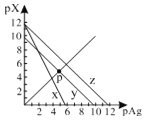
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:![]()
平衡Ⅱ:![]()
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ≤0.5 |
NH4+/mgL-1 | 2632 | ≤15 |
下列说法错误的是( )
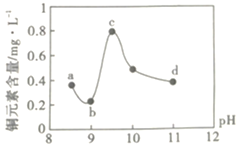
A.a~b段发生的反应为:![]()
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升