题目内容
【题目】已知常温下Ksp(AgCl)=1.8×10-10mol2/L2,Ksp(AgI)=1.0×10-16 mol2/L2。下列说法中正确的是
A. 在相同温度下AgCl的溶解度小于AgI的溶解度
B. AgCl和AgI都不溶于水,因此AgCl和AgI不能相互转化
C. 常温下,AgC1若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11mol/L
×10-11mol/L
D. 将足量的AgCl分别放入下列物质中:①20mL0.01mol/LKCl溶液 ②10mL0.02mol/LCaCl2溶液 ③30mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的顺序为: ③>②>①
【答案】C
【解析】A、由于AgCl和AgI的组成相同,所以用Ksp可直接判断其溶解度的大小,即AgCl的溶解度大于AgI的溶解度,所以A错误;B、溶液中的反应总是向着能使微粒浓度减小的方向进行,由于AgCl的溶解度大于AgI的,所以AgCl可以转化为AgI,故B错误;C、AgC1在溶液中电离产生的c(Ag+)= c(Cl—)= ![]() =
=![]() ×10-5mol/L,所以要转化为AgI,需要NaI的最小浓度为c(I—)=
×10-5mol/L,所以要转化为AgI,需要NaI的最小浓度为c(I—)= 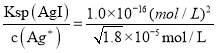 =
=![]() ×10-11mol/L,所以C正确;D、这三种溶液中的c(Ag+)和c(Cl—)的能抑制AgC1的溶解,即c(Ag+)或c(Cl—)越大,使AgC1的溶解度越小,与溶液的体积无关,所以AgCl在这三种溶液中的溶解度由大到小的顺序为:①>②>③,所以D错误。因此本题正确答案为C。
×10-11mol/L,所以C正确;D、这三种溶液中的c(Ag+)和c(Cl—)的能抑制AgC1的溶解,即c(Ag+)或c(Cl—)越大,使AgC1的溶解度越小,与溶液的体积无关,所以AgCl在这三种溶液中的溶解度由大到小的顺序为:①>②>③,所以D错误。因此本题正确答案为C。

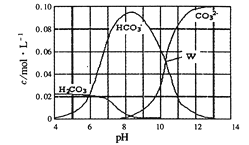
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是( )
A. 各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B. a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C. 冰醋酸中逐滴加水,则溶液的导电性和pH均先增大后减小
D. NaHCO3和Na2CO3混合溶液中,一定有2c(Na+)=3〔c(H2CO3)+c(HCO![]() )+c(CO
)+c(CO![]() )〕
)〕