题目内容
【题目】CO和H2在工业上常作为重要的化工原料,其混合气称为合成气。工业上CH4—H2O催化重整是目前大规模制取合成气的重要方法,其原理为:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+210 kJ/mol
CO(g)+3H2(g) H1=+210 kJ/mol
反应Ⅱ:CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=﹣41 kJ/mol
CO2(g)+H2(g) H2=﹣41 kJ/mol
(1)CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) H3=____ kJ/mol。
CO2(g)+4H2(g) H3=____ kJ/mol。
(2)反应Ⅰ达到平衡的标志是_____。
A.恒温恒容情况下,压强不再改变 B.v正(CO)=3v逆(H2)
C.平均相对分子质量不再改变 D.恒温恒容情况下,气体密度不再改变
(3)若容器容积不变,不考虑反应Ⅰ,对反应Ⅱ下列措施可增加CO转化率的是____。
A.升高温度 B.将CO2从体系分离
C.充入He,使体系总压强增大 D.按原投料比加倍投料
(4)将1 mol CH4(g)和1 mol H2O(g)加入恒温恒压的密闭容器中(温度298 K、压强100 kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),其中k正、k逆为速率常数,p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=___(以k正、k逆表示)。若该条件下k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=__kPa·s-1(保留两位有效数字)。
【答案】+169 AC B ![]() 4.9×107
4.9×107
【解析】
(1)根据盖斯定律,将已知热化学方程式叠加,可得待求反应的热化学方程式;
(2)当反应达到平衡时,任何一种物质的物质的量、浓度、密度等保持不变,据此判断;
(3)若提高CO的平衡转化率,则应该使化学平衡正向移动;
(4)根据平衡时v正= v逆计算化学平衡常数;根据CH4分解20%计算平衡时各种气体的物质的量得到气体的分压,带入速率公式计算。
(1)已知:反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+210 kJ/mol
CO(g)+3H2(g) H1=+210 kJ/mol
反应Ⅱ:CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=﹣41 kJ/mol,
CO2(g)+H2(g) H2=﹣41 kJ/mol,
根据盖斯定律,将I+II,整理可得:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) H3=+169 kJ/mol;
CO2(g)+4H2(g) H3=+169 kJ/mol;
(2)对于反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+210 kJ/mol,该反应的正反应为气体体积增大的吸热反应。
CO(g)+3H2(g) H1=+210 kJ/mol,该反应的正反应为气体体积增大的吸热反应。
A.恒温恒容情况下,若压强不再改变,说明气体的物质的量不变,反应达到平衡状态,A正确;
B.在任何条件下,3v正(CO)=v正(H2),若v正(CO)=3v逆(H2),则v正(H2)=9v逆(H2),反应正向进行,未达到平衡状态,B错误;
C.反应前后气体的质量不变,若平均相对分子质量不再改变,说明气体的物质的量不再发生变化,反应达到了平衡状态,C正确;
D.反应前后气体的质量不变,容器的容积不变,则气体密度始终不变,因此不能据此判断反应是否处于平衡状态,D错误;
故合理选项是AC;
(3)对于反应II:CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=﹣41 kJ/mol,该反应的正反应是气体体积不变的放热反应
CO2(g)+H2(g) H2=﹣41 kJ/mol,该反应的正反应是气体体积不变的放热反应
A.升高温度,化学平衡向吸热的逆反应方向移动,CO的转化率降低,A不符合题意;
B.将CO2从体系分离,即减小生成物浓度,平衡正向移动,达到平衡时CO的转化率提高,B符合题意;
C.充入He,反应体系总压强增大,由于该反应是反应前后气体体积不变的反应,因此增大压强,化学平衡不移动,CO转化率不变,C不符合题意;
D.按原投料比加倍投料,即增大压强,化学平衡不移动,物质转化率不变,D不符合题意;
故合理选项是B;
(4)对于反应CH4(g)+H2O(g)![]() CO(g)+3H2(g),由于v正=k正×p(CH4)×p(H2O),v逆=k逆×p(CO)×p3(H2),当反应达到平衡时,v正= v逆,则k正×p(CH4)×p(H2O)=k逆×p(CO)×p3(H2),
CO(g)+3H2(g),由于v正=k正×p(CH4)×p(H2O),v逆=k逆×p(CO)×p3(H2),当反应达到平衡时,v正= v逆,则k正×p(CH4)×p(H2O)=k逆×p(CO)×p3(H2),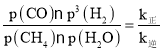 ,该反应的压强平衡常数Kp=
,该反应的压强平衡常数Kp=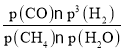 =
=![]() ;
;
将1 mol CH4(g)和1 mol H2O(g)加入恒温恒压的密闭容器中,发生该反应,若CH4分解20%,此时各种气体的物质的量为n(CH4)=n(H2O)=(1-20%)mol=0.8 mol,n(CO)=0.2 mol,n(H2)=0.6 mol,气体总物质的量为n(总)=0.8 mol+0.8 mol+0.2 mol+0.6 mol=2.8 mol。在恒温恒压下,气体的物质的量比等于气体的压强之比,所以平衡时各种气体所占分压:p(CH4)=p(H2O)=![]() ;p(CO)=
;p(CO)=![]() ;p(H2)=
;p(H2)=![]() ,气体总压强为100 kPa,根据此时k正=4.4×104kPa-1·s-1,则该条件下正反应速率v正=k正×p(CH4)×p(H2O)=4.4×104 kPa-1·s-1×(
,气体总压强为100 kPa,根据此时k正=4.4×104kPa-1·s-1,则该条件下正反应速率v正=k正×p(CH4)×p(H2O)=4.4×104 kPa-1·s-1×(![]() ×100 kPa)×(
×100 kPa)×(![]() ×100 kPa)= 4.9×107 kPa·s-1。
×100 kPa)= 4.9×107 kPa·s-1。

【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
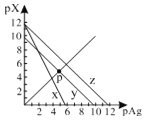
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
【题目】下列有关实验操作,现象和解释或结论都正确的是
| 操作 | 现象 | 解释或结论 |
A | 向某溶液中通入Cl2,再加入CCl4、振荡,静置 | 溶液分层,上层呈紫色 | 说明溶液中含有I- |
B | 向Fe(NO3)2溶液加入盐酸酸化的KSCN溶液 | 溶液变成血红色 | Fe(NO3)2已经变质 |
C | FeCl3溶液加入过量的KI溶液,再加入KSCN溶液 | 溶液变成血红色 | Fe3+与I-反应为可逆反应 |
D | 向玻璃片上分别滴几滴氢氟酸和NaOH溶液 | 玻璃片慢慢被腐蚀 | SiO2是两性氧化物能与酸、碱反应 |
A.AB.BC.CD.D
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:![]()
平衡Ⅱ:![]()
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ≤0.5 |
NH4+/mgL-1 | 2632 | ≤15 |
下列说法错误的是( )
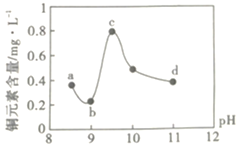
A.a~b段发生的反应为:![]()
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升