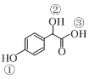
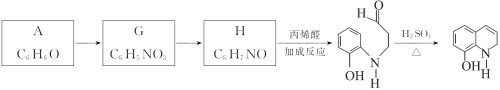
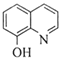
题目内容
【题目】18.4g由铁、铜组成的混合粉末加入100mL5.0molL﹣1FeCl3溶液中,充分反应后,剩余固体质量为3.2g。下列说法正确的是( )
A.原固体混合物中:n(Cu):n(Fe)=2:1
B.反应后溶液中的溶质有FeCl2、FeCl3、CuCl2
C.反应后溶液中:n(Fe2+)+n(Cu2+)=0.8mol
D.剩余固体是铁
【答案】A
【解析】
铁比铜活泼,因此先发生反应:Fe+2Fe3+=3Fe2+,再发生Cu+2Fe3+=3Fe2++Cu2+,原FeCl3溶液中FeCl3的物质的量n(FeCl3)=5.0molL﹣1×0.1L=0.5mol,结合方程式进行解答。
设0.5mol Fe3+完全反应消耗铁的质量为xg,铜为yg,那么
Fe + 2Fe3+ = 3Fe2+ Cu+ 2Fe3+ = 3Fe2+ + Cu2+
56g 2mol 64g 2mol
xg 0.5mol yg 0.5mol
x=![]() =14g, y=
=14g, y=![]() =16g,溶解的金属的质量为18.4-3.2=15.2g,且有14<15.2<16,说明铁完全反应反应而铜部分反应,有剩余;
=16g,溶解的金属的质量为18.4-3.2=15.2g,且有14<15.2<16,说明铁完全反应反应而铜部分反应,有剩余;
A. 根据分析可知,剩余的3.2g金属为Cu,物质的量为![]() =0.05mol,反应掉的铁和酮的质量为18.4-3.2=15.2g,56n(Fe)+64n(Cu)=15.2,2n(Fe)+2n(Cu)=0.5,解得n(Fe)=0.1mol,n(Cu)=0.15mol,因此铜的物质的量为0.15mol+0.05mol=0.2mol,原混合物中n(Cu):n(Fe)=2:1,A项正确;
=0.05mol,反应掉的铁和酮的质量为18.4-3.2=15.2g,56n(Fe)+64n(Cu)=15.2,2n(Fe)+2n(Cu)=0.5,解得n(Fe)=0.1mol,n(Cu)=0.15mol,因此铜的物质的量为0.15mol+0.05mol=0.2mol,原混合物中n(Cu):n(Fe)=2:1,A项正确;
B.由于铜有剩余,Fe3+完全反应,因此溶液中不存在Fe3+,B项错误;
C.根据方程式可知反应后溶液中n(Fe2+)=0.5+0.1=0.6mol,n(Cu2+)=0.15mol,因此n(Fe2+)+n(Cu2+)=0.75mol,C项错误;
D.剩余的固体是铜,不是铁,D项错误;
答案选A。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案