题目内容
17.根据中学所学相关知识,下列判断正确的一项是( )| A. | ⅣA族元素形成的氢化物的沸点从上到下依次递增,则ⅤA族元素所形成的氢化物的沸点从上到下也是依次递增 | |
| B. | 氯气可置换出KEr溶液中的溴,则氟气也可置换出KBr中的溴 | |
| C. | 某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-14+dmon•L-1 | |
| D. | 某温度下,MgCO3的Ksp=6.8×10-6,则该温度下所有含固体MgCO3的溶液,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.8×10-6 |
分析 A.氢键的形成使熔沸点升高;
B.氟气能与水反应生成氧气;
C.NaClO溶液水解显碱性,故溶液中的氢氧根离子为水电离的,由水电离出的c(H+)=c(OH-),依此进行计算;
D.含大量镁离子的溶液中,c(Mg2+)>c(CO32-).
解答 解:A.ⅣA族元素形成的氢化物的沸点从上到下依次递增,但ⅤA族元素所形成的氢化物中,由于NH3分子间可形成氢键,故沸点高于其他氢化物,故A错误;
B.氯气可置换出KEr溶液中的溴,但氟气能与水反应生成氧气,故氟气不能置换出KBr中的溴,故B错误;
C.某浓度的NaClO溶液的pH=d,则溶液中氢离子浓度为:c(H+)=1×10-dmol/L,则c(OH-)=10-14+dmon•L-1,溶液中的氢氧根离子为水电离的,所以由水电离的氢离子浓度为c(OH-)=10-14+dmon•L-1,故C正确;
D.若溶液中镁离子浓度很大,则沉淀溶解平衡逆向移动,c(Mg2+)>c(CO32-),但温度不变,c(Mg2+)•c(CO32-)=6.8×10-6,故D错误;
故选C.
点评 本题考查氢键的性质、卤族单质的性质、盐类的水解,及沉淀的溶解平衡等知识,难度不大.要注意氢键对物质物理性质的影响.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 葡萄糖能水解成乙醇和二氧化碳 | |
| B. | 氨基乙酸、甲醛、乙二醇均可发生聚合反应 | |
| C. | 苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强 | |
| D. | 实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯 |
12.25℃时,溶液均为0.1mol/L的溶液,其pH如表所示,下列有关说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH4COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)=0.1mol/L |
2.下列离子方程式或化学方程式与所述事实相符且正确的是( )
| A. | 已知电离常数如表,则2NaF+H3PO4═2HF+Na2HPO4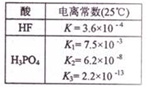 | |
| B. | 以金属铜为电极电解饱和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向0.1mol?L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| D. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O |
9.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| C. | 1L0.1mol•L-1的氨水中有0.1NA个N原子 | |
| D. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |

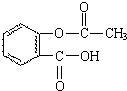 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.
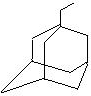 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
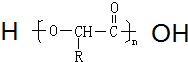 .
.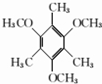 .
.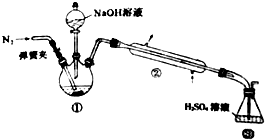 某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验:
某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验: