题目内容
15.下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺序排列的一组是( )| A. | Cl2、Al、H2 | B. | F2、K、HCl | C. | NO2、Na、Br2 | D. | HNO3、SO2、H2O |
分析 判断物质的氧化性和还原性,需从两个反面入手,1.熟悉物质的性质,2.物质所含元素的化合价,如果物质所含元素处于中间价态,则物质既有氧化性又有还原性,处于最低价,只有还原性,处于最高价,只有氧化性.
解答 解:A、Cl2既有氧化性又有还原性,金属铝还原性,氢气既有氧化性又有还原性,故A错误;
B、氟气只有氧化性,F2化合价只能降低,K化合价只能升高,所以金属钾只有还原性,盐酸和金属反应表现氧化性,和高锰酸钾反应表现还原性,故B正确;
C、二氧化氮和水的反应说明二氧化氮既有氧化性又有还原性,金属钠只有还原性,溴单质既有氧化性又有还原性,故C错误;
D、二氧化硫中硫元素居于中间价,既有氧化性又有还原性,故D错误.
故选B.
点评 本题考查了氧化还原反应,主要是对氧化性和还原性的判断和理解,题目难度不大,侧重于基础知识的考查,注意知识的积累.

练习册系列答案
相关题目
20.化学与生活息息相关.下列说法正确的是( )
| A. | 纳米碳酸钙材料能够产生丁达尔效应 | |
| B. | NOx、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 纯碱可用于制造玻璃,也可用于除去物品表面的油污 | |
| D. | 糖类、油脂、蛋白质均能发生水解反应 |
3.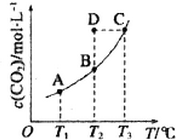 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )
 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)为吸热反应 | |
| B. | 在T2时,若反应处于状态D,则一定有υ正>υ逆 | |
| C. | 平衡状态A 与C 相-比,平衡状态A 的c(CO)大 | |
| D. | 若T1、T2 时的平衡常数分别为K1、K2则K1>K2 |
10.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| B. | 气态氢化物的热稳定性:M>N | |
| C. | M与X的化合物对应的水化物一定是强酸 | |
| D. | 离子半径r:r(X2-)>(r+) |
20.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1NaHC2O4溶液与0.1mol•L-1KOH溶液等体积混合,所得溶液中:c(Na+)>c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-) | |
| B. | 20mL 0.1 mol•L-1 NH4Cl溶液与10mL 0.1mol•L-1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| D. | 0.1mol•L-1 NH3•H2O溶液与0.1mol•L-1HNO3等体积混合,所得溶液中:c(H+)>c(OH-)+c(NH3•H2O) |
7.下列离子能大量共存的是( )
| A. | 含大量 H+的溶液中:CrO42-、Cl-、N03-、Na+ | |
| B. | 含大量 A102-的溶液中:Na+、K+、NO3-、HCO3- | |
| C. | 含大量 Al3+的溶液中:K+、Na+、NO3-、Cl0- | |
| D. | 含大量 CH3COO- 的溶液中:NH4+、Cl-、F-、K+ |
5.亚磷酸(H3PO3)是二元弱酸,且具有较强还原性.下列说法正确的是( )
| A. | Na2HPO3溶液显碱性,说明HPO32-的电离程度大于水解程度 | |
| B. | 25℃时,将0.1 mol•L-1的亚磷酸溶液加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| C. | 利用H3PO3进行化学镀银,当参加反应的$\frac{n(A{g}^{+})}{n({H}_{3}P{O}_{3})}$=2时,氧化产物为H3PO4 | |
| D. | NaH2PO3溶液显酸性,其溶液中存在的粒子浓度关系:c(H2PO3-)>c(HPO32-)>c(H3PO3)>c(H+)>c(OH-) |
 .
.