题目内容
20.化学与生活息息相关.下列说法正确的是( )| A. | 纳米碳酸钙材料能够产生丁达尔效应 | |
| B. | NOx、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 纯碱可用于制造玻璃,也可用于除去物品表面的油污 | |
| D. | 糖类、油脂、蛋白质均能发生水解反应 |
分析 A.一种或几种物质分散在另一种物质中所形成的体系称为分散系;
B.PM2.5是造成灰霾天气的“元凶”之一,与酸雨无关;
C.纯碱水解呈碱性,可用于除油污,结合玻璃的成分判断;
D.单糖在催化剂的作用下不能发生水解反应.
解答 解:A.纳米碳酸钙是纯净物,分散系是混合物,故A错误;
B.酸雨是指溶液pH小于5.6的雨水,正常雨水的pH约为5.6,二氧化硫、氮氧化物等物质是形成酸雨的重要物质,二氧化碳排放过多会引起温室效应,不是形成酸雨的气体,PM2.5是造成灰霾天气的“元凶”之一,所以PM2.5颗粒都不会导致酸雨,故B错误;
C.纯碱水解呈碱性,可用于除油污,玻璃的原料有二氧化硅、碳酸钠等,故C正确;
D.糖类中单糖如葡萄糖不能发生水解,故D错误.
故选C.
点评 本题考查较为综合,涉及胶体、酸雨、纯碱以及糖类、油脂、蛋白质的性质等知识,侧重于化学与生产、生活等考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.氢氧化锂(LiAlH4)既是金属储氢材料又是有机合成中常用的试剂,溶于适量的水可得到无色溶液:LiAlH4+2H2O═LiAlO2+4H2↑,在125℃分解为LiH、H2和Al.下列说法不正确的是( )
| A. | LiAlH4中H元素的化合价为-1 | |
| B. | LiAlH4L、iAlO2、LiH均是离子化合物 | |
| C. | 1mol LiAlH4在125℃完全分解,转移4mol电子 | |
| D. | 0.5 mol LiAlH4与水充分反应后产生44.8L H2 |
11.对下列装置的叙述错误的是( )
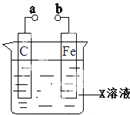

| A. | X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 | |
| B. | X如果是氯化钠,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 | |
| C. | X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 | |
| D. | X如果是氢氧化钠,将碳电极改为铝电极,a和b用导线连接,此时构成原电池铁作负极 |
12. 二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247KJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205KJ•mol-1
则反应CO2(g)+4H2(g)?CH2(g)+2H2O(g)的△H3=-165kJ•mol-1
(2)在一定压强下,在某恒定密闭容器中充入H2和CO2发生反应:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向正方向移动;
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,
H2的转化率为40%若达到平衡后,H2的浓度为a mol•L-1,则达到平衡时CH3CH2OH的浓度为0.1amol•L-1.
(3)CO2和H2在一定条件下可合成二甲醛:2CO2(g)+6H2(g)?CH3OH(g)+3H2O(g)△H.在一定压强下,将2.5mol H2与a mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据都如表:
①x,y的大小关系为B
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z,ω时,达到平衡的时间前者长
D.转化率分别为y,ω时,平衡常数不同.
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247KJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205KJ•mol-1
则反应CO2(g)+4H2(g)?CH2(g)+2H2O(g)的△H3=-165kJ•mol-1
(2)在一定压强下,在某恒定密闭容器中充入H2和CO2发生反应:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,
H2的转化率为40%若达到平衡后,H2的浓度为a mol•L-1,则达到平衡时CH3CH2OH的浓度为0.1amol•L-1.
(3)CO2和H2在一定条件下可合成二甲醛:2CO2(g)+6H2(g)?CH3OH(g)+3H2O(g)△H.在一定压强下,将2.5mol H2与a mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据都如表:
①x,y的大小关系为B
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z,ω时,达到平衡的时间前者长
D.转化率分别为y,ω时,平衡常数不同.
9.有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3.电池的总反应式为2H2+O2═2H2O,负极反应为H2+CO32--2e-═H2O+CO2.该电池放电时,下列说法中正确的( )
| A. | 正极反应为2CO2+O2+4e-═2CO32- | |
| B. | CO32-向正极移动 | |
| C. | 电子由正极经外电路流向负极 | |
| D. | 电池中CO32-的物质的量将逐渐减少 |
15.下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺序排列的一组是( )
| A. | Cl2、Al、H2 | B. | F2、K、HCl | C. | NO2、Na、Br2 | D. | HNO3、SO2、H2O |