题目内容
15. 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按如图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按如图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.(1)实验室欲配制10%的NaHCO3溶液,所需仪器有:烧杯、玻璃棒、药匙、托盘天平、量筒(写出另外两种)
(2)产生的气体是CO2(填分子式).
【查阅资料】:FeCO3为白色固体,不溶于水,在干燥空气中稳定,潮湿环境中需较长时间才能被氧化为Fe(OH)3.
(3)关于白色沉淀的成分,小组同学提出如下假设,请补充完成假设3:
假设l:白色沉淀是Fe(OH)2;
假设2:白色沉淀是FeCO3;
假设3:白色沉淀是Fe(OH)2和FeCO3.
(4)若假设2成立,写出生成FeCO3的离子方程式:FeSO4+2NaHCO3=Fe(OH)2↓+Na2SO4+2CO2↑.经煮沸后冷却的蒸馏水配制FeSO4溶液的目的是除去水中溶解的氧气,防止生成的Fe(OH)2被迅速氧化.某同学认为白色沉淀不可能为Fe(OH)2,你是否同意其观点?不同意.(填“同意”或“不同意”).
(5)请设计一个实验方案,验证假设2是否成立.向生成白色沉淀的试管中通入空气,若白色沉淀长时间内不变色,则假设2成立;或向生成白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则假设2不成立.
分析 (1)配制10%的NaHCO3溶液,需要用托盘天平量取碳酸氢钠的质量,还需要用量筒量取水的体积;
(2)亚铁离子和碳酸氢根离子发生双水解反应生成CO2;
(3)白色固体可能是Fe(OH)2和FeCO3的混合物;
(4)FeSO4和NaHCO3反应生成Fe(OH)2沉淀、二氧化碳和硫酸钠;二价铁不稳定,易被氧气氧化而干扰实验;碱性条件下,亚铁离子生成Fe(OH)2沉淀;
(5)如果白色沉淀是Fe(OH)2,Fe(OH)2不稳定,极易被氧化生成Fe(OH)3;FeCO3在干燥空气中稳定,潮湿环境中需较长时间才能被氧化为Fe(OH)3,通入空气后根据白色固体变色时间长短判断白色沉淀成分.
解答 解:(1)实验室欲配制10%的NaHCO3溶液,所需仪器有:烧杯、玻璃棒、药匙,还缺少称量碳酸氢钠质量的仪器托盘天平及量取水的体积的仪器量筒,
故答案为:托盘天平;量筒;
(2)亚铁离子和碳酸氢根离子发生双水解反应生成氢氧化亚铁和CO2,所以生成的气体是CO2,故答案为:CO2;
(3)白色固体可能是Fe(OH)2和FeCO3的混合物,所以假设3为白色固体是Fe(OH)2和FeCO3,故答案为:Fe(OH)2和FeCO3;
(4)FeSO4和NaHCO3反应生成Fe(OH)2沉淀、二氧化碳,根据元素守恒知还生成硫酸钠,反应方程式为FeSO4+2NaHCO3=Fe(OH)2↓+Na2SO4+2CO2↑;
二价铁不稳定,易被氧气氧化而干扰实验,所以经煮沸后冷却的蒸馏水配制FeSO4和NaHCO3溶液的目的是除去水中溶解的氧气,防止生成的氢氧化亚铁被迅速氧化;
反应体系进行了无氧处理并且碳酸氢钠水解提供了碱性环境,所以白色沉淀中一定含有氢氧化亚铁,
故答案为:FeSO4+2NaHCO3=Fe(OH)2↓+Na2SO4+2CO2↑;除去水中溶解的氧气,防止生成的氢氧化亚铁被迅速氧化;不同意;
(5)如果白色沉淀是Fe(OH)2,Fe(OH)2不稳定,极易被氧化生成Fe(OH)3;FeCO3在干燥空气中稳定,潮湿环境中需较长时间才能被氧化为Fe(OH)3,通入空气后根据白色固体变色时间长短判断白色沉淀成分,所以其实验步骤、预期现象和结论为:向生成的白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则假设2不成立;若白色沉淀短时间内不变色,则假设2成立,
故答案为:向生成的白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则假设2不成立;若白色沉淀短时间内不变色,则假设2成立.
点评 本题考查性质实验方案设计,题目难度中等,侧重考查学生分析、判断及实验操作能力,明确实验原理及物质性质是解本题关键,难点是(5)实验方案设计方法,需要利用物质性质的不同点设计方案.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. |  | B. | K+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | ||
| C. |  | D. | 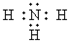 |
| A. | C2H6 | B. | C4H8 | C. | C3H8 | D. | C3H6 |
| A. | a=b+m-n | B. | a=b-m+n | C. | a-m=b+n | D. | a-m=b-n |
| A. | Li、Na同主族,因为Na在空气中加热生成Na2O2,所以Li在空气中加热生成Li2O2 | |
| B. | F、Cl同主族,因为HCl是强酸,所以HF也是强酸 | |
| C. | Li、Na同主族,因为Na保存在煤油中,所以Li也保存在煤油中 | |
| D. | F、Cl同主族,因为Cl2也是有色气体,所以F2也是有色气体 |
| A. | ns2 | B. | ns2np1 | C. | ns2np4 | D. | ns2np5 |
(1)探究溶液酸碱性的影响:将等量的2,4-DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强,有利于 (填“有利于”或“不利于”)Na2S2O8产生SO4-•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L-1 H2SO4洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4-DMAP)=1.0×10 -3mol•L-1、c(Na2S2O8)=4.2×10-3mol•L-1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4-DMAP降解的平均反应速率为2.0×10-5mol/(L•min)(忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH-,S2O8-+Fe2+=SO4-+SO42-+Fe3+此外还可能会发生:SO4-+Fe2+=SO42-+Fe3+.当铁粉加入量过大时,2,4-DMAP的降解率反而下降,原因可能是(用离子方程式表示).Fe+2Fe3+=3Fe2+,SO4-+Fe2+=SO42-+Fe3+.
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
| 序号、物理量 | M(Fe粉)/g | V[0.05mol.L-1Na2S2O8]/mL | V[H2O]/mL | 收集数据和得出结论 | |
| 1 | 100 | 0.3 | 50 | 50 | |
| 2 | 100V(污水)/mL | 0.3 |

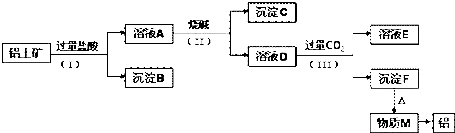
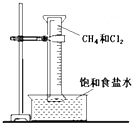 如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:
如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题: