题目内容
5.下列电子式,正确的是( )| A. | 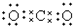 | B. | K+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | ||
| C. | 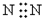 | D. |  |
分析 A、根据稳定结构判断,二氧化碳中碳原子与氧原子之间形成2对共用电子对;
B、氢氧化钾为离子化合物,钾离子与氢氧根是离子键,O与H形成共价键;
C、氮气分子中存在氮氮三键,氮原子最外层为8电子;
D、氨气分子的氮原子中含有孤电子对.
解答 解:A、二氧化碳中碳原子与氧原子之间形成2对共用电子对,电子式为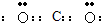 ,故A错误;
,故A错误;
B、氢氧化钾为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: ,故B正确;
,故B正确;
C、N2,氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,故C错误;
,故C错误;
D、氨气分子的电子式为: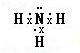 ,故D正确,故选BD.
,故D正确,故选BD.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
15.羟基扁桃酸可由苯酚和乙醛酸通过一步反应制得,下列有关说法正确的是( )
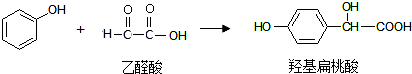

| A. | 羟基扁桃酸可以发生加成反应 | |
| B. | 上述反应属于取代反应 | |
| C. | 乙醛酸的核磁共振氢谱中有2个吸收峰 | |
| D. | 羟基扁桃酸能发生消去反应 |
16. 现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
(1)滴定管如图所示,用乙滴定管盛装0.2500mol/L氢氧化钠标准液 (填“甲”或“乙”).根据所给数据,该盐酸溶液的浓度为0.2632 mol/L
(2)现实验室中有石蕊和酚酞两种指示剂,该实验应选酚酞作指示剂,判断滴定终点的现象是滴入最后一滴标准液,溶液由无色变成浅红色,且半分钟内不恢复原来的颜色
(3)下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
 现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:| 实验编号 | 待测液体积/mL | 所消耗氢氧化钠标准液的体积/mL |
| 1 | 25.00 | 26.30 |
| 2 | 25.00 | 26.34 |
| 3 | 25.00 | 19.36 |
(2)现实验室中有石蕊和酚酞两种指示剂,该实验应选酚酞作指示剂,判断滴定终点的现象是滴入最后一滴标准液,溶液由无色变成浅红色,且半分钟内不恢复原来的颜色
(3)下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
13.下列说法中,不正确的是( )
| A. | 硫既可做氧化剂,又可做还原剂 | B. | SO3只有氧化性 | ||
| C. | 可以用铁罐贮运冷的浓H2SO4 | D. | H2S既有氧化性又有还原性 |
10.某实验小组做乙醛和新制氢氧化铜的反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5mL 40%的乙醛溶液进行下列实验.
(1)上表中a、b应为B(填字母序号).
A.15滴,1mL B.2mL,1mL
C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀.该反应的化学方程式为CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O.
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
A.15滴,1mL B.2mL,1mL
C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀.该反应的化学方程式为CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O.
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
14.除去下列物质中含有的少量杂质,请选择合适的所给试剂、操作方法填入下表中(只填序号)
试剂:A.溴水 B.NaOH溶液 C.CaO D.酸性KMnO4 溶液 E.饱和Na2CO3溶液
操作方法:a.蒸馏 b.分液 c.洗气 d.过滤 e.干馏 f.分馏 g.裂化
试剂:A.溴水 B.NaOH溶液 C.CaO D.酸性KMnO4 溶液 E.饱和Na2CO3溶液
操作方法:a.蒸馏 b.分液 c.洗气 d.过滤 e.干馏 f.分馏 g.裂化
| 组别 | 物质 | 杂质 | 试剂 | 操作方法 |
| 1 | 乙烷 | 乙烯 | ||
| 2 | 溴苯 | 溴 | ||
| 3 | 乙酸乙酯 | 乙酸 | ||
| 4 | 乙醇 | 水 | ||
| 5 | 将重油转化为汽油 | |||
| 6 | 把煤转化为焦炉气、煤焦油和焦炭等 | |||
 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按如图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按如图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.