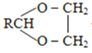
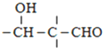题目内容
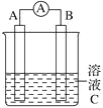
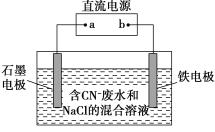
【题目】工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有:
①CN--2e-+2OH-=CNO-+H2O
②2Cl--2e-=Cl2↑
③3Cl2+2CNO-+8OH-=N2+6Cl-+2CO![]() +4H2O
+4H2O
下列说法正确的是
A.铁电极上发生的反应为Fe-2e-=Fe2+
B.通电过程中溶液pH不断增大
C.除去1 mol CN-,外电路至少需转移5 mol电子
D.为了使电解池连续工作,需要不断补充NaCl
【答案】C
【解析】
根据电极反应式及图像中有Fe电极可知,阳极为石墨电极,CN-失电子,阴极为铁电极,得电子,可确定a为电池的正极,b为负极。
A.铁电极为电解池的阴极,得电子,则只能是水提供的氢离子得电子,A错误;
B.根据电极反应式,阴极为2H2O+2e-= H2↑+2OH-,阳极①CN--2e-+2OH-=CNO-+H2O,②2Cl--2e-=Cl2↑③3Cl2+2CNO-+8OH-=N2+6Cl-+2CO![]() +4H2O,得失电子数相等时,在消耗氢氧根离子,pH在减小,B错误;
+4H2O,得失电子数相等时,在消耗氢氧根离子,pH在减小,B错误;
C. 根据反应:3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O,除去1mol CN-,消耗1.5mol氯气,转移电子3mol,根据CN--2e-+2OH-═CNO-+H2O,转移电子是2mol,所以外电路至少需转移5mol电子,C正确;
D. 根据电极反应的离子,为了使电解池连续工作,需要补充氢氧化钠,若有氯气溢出,则需要补充氯化钠,D错误;
答案为C。

练习册系列答案
相关题目