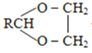
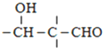题目内容
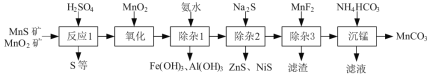
【题目】(一种由天然MnO2矿与MnS矿(还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备高纯碳酸锰工艺如下:
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
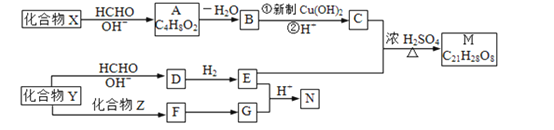
⑴“反应1”中MnO2与MnS反应的化学方程式为______。
⑵“反应1”后所得沉淀物中除S外,一定还含有的氧化物是______(填化学式)。
⑶“除杂2”后溶液中c(Zn2+)=1×105 mol·L1,则溶液中c(Ni2+)=______mol·L1。[已知:Ksp(ZnS)=2×1022,Ksp(NiS)=1×1024]
⑷“滤渣”的成分为______(填化学式);“滤液”中所含溶质的主要成分为___(填化学式)。
⑸将部分MnCO3溶于稀硫酸,所得溶液电解可制得MnO2循环使用。写出电解时所发生反应的离子方程式:______。
【答案】MnO2+MnS+2H2SO4=2MnSO4+S+2H2O SiO2 5×10-8 MgF2 Na2SO4、(NH4)2SO4 Mn2++2H2O ![]() MnO2↓+ 2H++H2↑
MnO2↓+ 2H++H2↑
【解析】
根据流程:二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)在硫酸中酸浸,主要的反应为:MnO2+MnS+2H2SO4=2MnSO4+S+2H2O,SiO2不溶于硫酸,过滤,得到的固体含有S和SiO2,滤液含有Mn2+、Fe2+、Fe3+、Al3+、Mg2+、Zn2+、Ni2+,加入MnO2将Fe2+氧化为Fe3+,加入氨水调节pH4.7~6之间,除去Fe3+、Al3+,除杂1为Fe(OH)3、Al(OH)3,滤液中加入Na2S除去Zn2+和Ni2+,除杂2的主要成分是NiS和ZnS,加入MnF2生成MgF2沉淀除去Mg2+,除杂3的滤渣为MgF2,加入碳酸氢铵发生反应:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,沉锰后滤液主要含有Na2SO4、(NH4)2SO4。
(1) “反应1”中二氧化锰与硫化锰反应为:MnO2+MnS+2H2SO4=2MnSO4+S+2H2O,
答案为:MnO2+MnS+2H2SO4=2MnSO4+S+2H2O;
⑵Si元素以SiO2的形式存在,SiO2不溶于硫酸, “反应1”后所得沉淀物中除S外,一定还含有的氧化物是SiO2,
答案为:SiO2;
⑶“除杂2”后溶液中c(Zn2+)=1×105 mol·L1,则c(S2-)=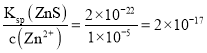 ,
,
c(Ni2+)=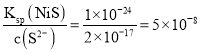 ,
,
答案为:5×10-8;
⑷根据分析,加入MnF2生成MgF2沉淀除去Mg2+,除杂3的滤渣为MgF2,加入碳酸氢铵发生反应:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,沉锰后滤液主要含有Na2SO4、(NH4)2SO4,
答案为:MgF2;Na2SO4、(NH4)2SO4;
⑸将部分MnCO3溶于稀硫酸,得硫酸锰溶液,电解可制得MnO2,电解时所发生反应的离子方程式:Mn2++2H2O ![]() MnO2↓+ 2H++H2↑。
MnO2↓+ 2H++H2↑。
答案为:Mn2++2H2O ![]() MnO2↓+ 2H++H2↑。
MnO2↓+ 2H++H2↑。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |