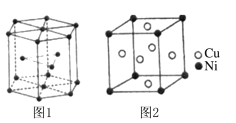
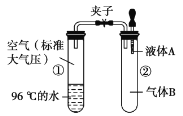
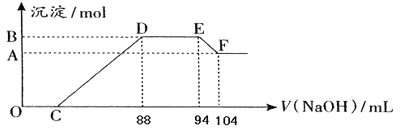
题目内容
【题目】图是硫酸试剂标签上的部分内容。下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol/L
B.1mol锌与足量的该硫酸反应产生2g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2 mol/L
【答案】C
【解析】
A.c=![]() =
=![]() mol/L=18.4mol/L,故A错误;
mol/L=18.4mol/L,故A错误;
B.该溶液为浓硫酸,与锌反应生成二氧化硫气体,没有氢气生成,故B错误;
C.设准确配制200mL4.6mol/L的稀硫酸需取该硫酸的体积为V,应需要200mL容量瓶,溶液稀释前后溶质的物质的量不变,则有:0.2L×4.6mol/L=V×18.4mol/L,V=![]() =0.05L,即50mL,故C正确;
=0.05L,即50mL,故C正确;
D.硫酸的密度大于水的密度,该硫酸与等体积的水混合所得溶液的体积小于原来的2倍,则物质的量浓度大于9.2 mol/L,故D错误;
故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目