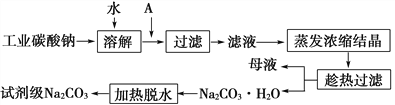
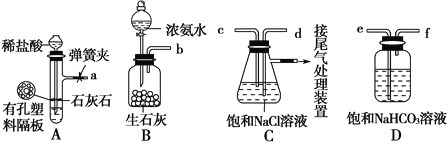
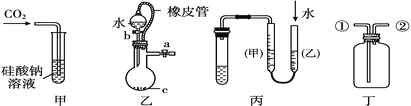
题目内容
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示:

(1)B与A的差值为________mol。
(2)C点对应的溶液体积为________mL。
(3)原硝酸溶液中含硝酸的物质的量为________mol。
(4)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为_______________。
(5)写出铝与该浓度硝酸反应的离子方程式_______________________。
【答案】 0.05 40 0.5 5∶3 8Al+3OH++3NO![]() ===8Al3++3NH
===8Al3++3NH![]() +9H2O
+9H2O
【解析】考查化学计算,(1)E→F发生Al(OH)3+OH-=AlO2-+2H2O,B与A的差值为Al(OH)3的物质的量,即物质的量为(104-94)×10-3×5mol=0.05mol;(2)O到C没有沉淀产生,说明HNO3过量,D→E发生NH4++OH-=NH3·H2O,推出n(NH4+)=(94-88)×10-3×5mol=0.03mol,根据得失电子数目守恒,因此有n(Al)×3+n(Fe)×3=n(NH4+)×8,代入数值,解得n(Fe)=0.03mol,C→D发生Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,此阶段共消耗NaOH的体积为(0.03+0.05)×3×1000/5mL=48mL,因此C点对应的数值为(88-48)mL=40mL;(3)E点溶质为NaNO3,因此n(NO3-)=94×10-3×5mol=0.47mol,根据N元素守恒,因为合金与硝酸反应过程中没有气体产生,因此原硝酸溶液中n(HNO3)=n(NO3-)+n(NH4+)=(0.47+0.04)mol=0.5mol;(4)根据(2)的分析,合金中铝粉和铁粉的物质的量比值为0.05:0.03=5:3;(5)根据上述分析,硝酸被还原成NH4+,因此离子反应方程式为:8Al+3OH++3NO3- =8Al3++3NH4+ +9H2O。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案