题目内容
【题目】甲烷作为天然气、页岩气、可燃冰的主要成分,拥有最稳定的烷烃分子结构,具有高度的四面体对称性,极难在温和的条件下对其活化。因此,甲烷的选择活化和定向转化一直是世界性的难题。我国科学家经过长达6年的努力,研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂材料,在室温条件下以H2O2为氧化剂直接将甲烷氧化成C1(只含一个C原子)含氧化合物,被业内认为是甲烷化学领域的重要突破。请回答下列问题:
(1)Cu原子基态原子的外围电子排布式为____________。
(2)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____(减弱”或“不变”)。铁晶体中粒子之间作用力类型是__________________。
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①它们的沸点分别为64.7、-195℃、100.8℃,其主要原因是_________________;
②CH4 和HCHO比较,键角较大的是_________,主要原因是_____________。
(4)配离子的颜色与d-d电子跃迁的分裂能大小有关,1个电子从较低的d轨道跃迁到较高能量的轨道所需的能量为的分裂能,用符号△表示。分裂能△[Co(H2O)62+]_____________△[Co(H2O)63+](填“>”“<”或“=”),理由是_________________。
(5)钴晶胞和白铜(铜镍合金)晶胞分别如图1、图2所示。
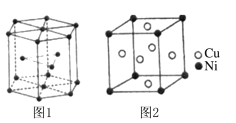
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dg·cm-3 ,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____________pm(列出计算式)。
【答案】3d10s1; 减弱; 金属键; CH3OH、HCOOH中存在氢键,CH3OH中氢键较弱,而HCHO只存在范德华力; HCHO CH4构型为正四面体,键角为109。28〃,HCHO为平面三角形,键角为120。; <; 前者带2个正电荷,后者带3个正电荷,后者对电子的吸引能力较大; 六方最密堆积; 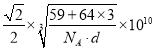
【解析】
(1)Cu原子基态原子的外围电子排布式为3d10s1;
(2)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力减弱。铁晶体中粒子之间作用力类型为金属键。
(3) ①常温下 CH3OH、HCHO、 HCOOH的沸点不同,是因为CH3OH与HCOOH有氢键,且CH3OH中氢键比HCOOH中氢键弱,而HCHO中只有范德华力。
②CH4 和HCHO比较,键角较大的是CH4,主要原因是CH4构型为正四面体,键角为109。28〃,HCHO为平面三角形,键角为120。;
(4)由于Co(H2O)62+带2个正电荷,Co(H2O)63+带3个正电荷,后者对电子的吸引能力较大;所以分裂能前者小于后者;
(5) ①钴晶胞堆积方式的名称为六方最密堆积;
②由图可知,白铜晶胞中含有Ni原子1个,Cu原子3个,根据密度公式![]() ,可得出
,可得出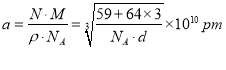 ,所以两个面心上铜原子最短核间距为
,所以两个面心上铜原子最短核间距为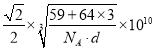 pm。
pm。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案