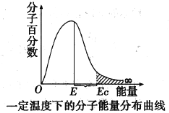
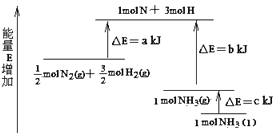
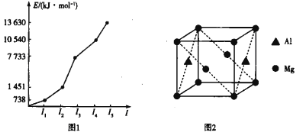
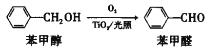题目内容
【题目】NaHCO3溶液中粒子浓度关系判断。
①离子浓度大小关系__;
②电荷守恒关系__;
③物料守恒关系__;
④质子守恒关系__。
【答案】c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
【解析】
溶液中所有电离、水解方程式NaHCO3=Na++HCO3-、HCO3-+H2O![]() H2CO3+OH-、HCO3-
H2CO3+OH-、HCO3-![]() H++CO32-、H2O
H++CO32-、H2O![]() H++OH-。粒子种类Na+、HCO3-、H2CO3、CO32-、H+、OH-、H2O。
H++OH-。粒子种类Na+、HCO3-、H2CO3、CO32-、H+、OH-、H2O。
①一般来说,水解是微弱的,但是强于水的电离。由于HCO3-发生水解,则c(Na+)>c(NaHCO3-);HCO3-水解得到OH-,水电离也得到OH-,则c(OH-)>c(H+);HCO3-电离得到H+,水电离也得到H+,则c(H+)>c(CO32-);离子浓度大小关系为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
②溶液中阳离子所带正电荷的浓度等于阴离子所带负电荷的浓度,有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);
③溶质为NaHCO3,溶液中含Na和含C的微粒的浓度相同,则有c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3);
④结合电荷守恒和物料守恒,可以得到质子守恒,有c(OH-)+c(CO32-)=c(H2CO3)+c(H+)。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目