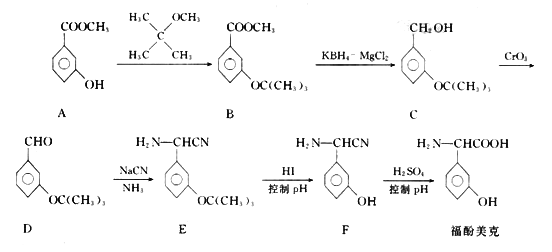
题目内容
【题目】在一密闭容器中(容积为5L),充入氨气和氧气,使其物质的量之比为1∶2,并发生如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),此反应在一定条件下进行2min后,测得NH3的物质的量为2mol,NH3的转化率为20%。
4NO(g)+6H2O(g),此反应在一定条件下进行2min后,测得NH3的物质的量为2mol,NH3的转化率为20%。
(1)以NO的浓度变化表示该反应的平均反应速率是________。
(2)O2在2min时的浓度是________。
【答案】0.05mol/(L·min) 0.875 mol/L
【解析】
假如NH3起始物质的量为x,利用反应开始时氨气和氧气的物质的量之比为1∶2,可知O2在反应开始时物质的量是2x,利用NH3平衡转化率是20%,可知反应的NH3的物质的量,根据物质反应转化关系可得平衡时各种物质的物质的量,利用v=![]() 计算v(NO);利用c=
计算v(NO);利用c=![]() 计算物质的平衡浓度。
计算物质的平衡浓度。
(1)设充入NH3的物质的量为x,NH3达到平衡时NH3的转化率为20%,则平衡时NH3的物质的量为x(1-20%)=2mol,解得x=2.5mol,由于反应开始时充入氨气和氧气的物质的量之比为1∶2,则O2开始浓度为2×2.5mol=5.0mol,反应的氨气的物质的量为△n(NH3)=0.5mol,根据方程式4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)中物质转化关系:每反应消耗NH3 4mol,会同时消耗5mol O2,反应产生4mol NO,则反应了0.5mol NH3,消耗O2的物质的量是△n(O2)=0.5mol×
4NO(g)+6H2O(g)中物质转化关系:每反应消耗NH3 4mol,会同时消耗5mol O2,反应产生4mol NO,则反应了0.5mol NH3,消耗O2的物质的量是△n(O2)=0.5mol×![]() =0.625mol,n(NO)=0.5mol,所以v(NO)=
=0.625mol,n(NO)=0.5mol,所以v(NO)= =0.05mol/(L·min);
=0.05mol/(L·min);
(2)反应开始时n(O2)=5mol,平衡时n(O2)=5mol-0.625mol=4.375mol,所以O2在2min时的浓度是c(O2)=![]() =0.875mol/L。
=0.875mol/L。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案