题目内容
20.表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)在短周期中,元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)在②⑦⑩元素中,原子半径最大的是Br,原子半径最小的是F;
(4)在③与⑨的单质中,化学性质较活泼的是K,写出其与水反应的化学方程式:2K+2H2O=2KOH+H2↑.
分析 表中的①~⑩中元素分别是N、F、Na、Mg、Al、Si、Cl、Ar、K、Br元素,
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,稀有气体化学性质最不活泼;
(2)F元素没有最高价含氧酸,其次是Cl的非金属性最强,非金属性越强,其最高价氧化物对应水化物的酸性越强,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,氢氧化铝能与酸、碱反应生成相应的盐与水,属于两性氢氧化物;
(3)同主族元素从上到下原子半径逐渐增大;
(4)同主族元素从上到金属性逐渐增强,元素的金属性越强,对应的单质活泼性越强,钾与水反应生成氢氧化钾和氢气.
解答 解:由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
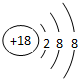
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述原子中,K的金属性最强,F的非金属性最强,稀有气体Ar最外层达到了8个电子的稳定结构,故化学性质最不活泼,原子结构示意图为 ,故答案为:K;F;Ar;
,故答案为:K;F;Ar; ;
;
(2)F元素没有最高价含氧酸,故上述元素中最高价氧化物对应的水化物中酸性最强的是HClO4,K的金属性最强,对应的碱KOH的碱性最强,Al(OH)3能与酸、碱反应生成相应的盐与水,属于两性氢氧化物,故答案为:HClO4;KOH;Al(OH)3;
(3)同主族元素从上到下原子半径逐渐增大,则原子半径最大的为Br,原子半径最小的为F,故答案为:Br;F;
(4)同主族元素从上到金属性逐渐增强,元素的金属性越强,对应的单质活泼性越强,钾与水反应生成氢氧化钾和氢气,反应的方程式为2K+2H2O=2KOH+H2↑,
故答案为:K;2K+2H2O=2KOH+H2↑.
点评 本题考查了元素周期表和元素周期律综合应用,涉及化学基本用语、氧化还原反应等知识点,根据物质结构、元素周期律等知识点分析解答即可,题目难度不大.

| A. | 水 | B. | 无水酒精 | C. | 四氯化碳 | D. | 氢氧化钠溶液 |
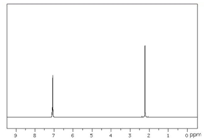
| A. |  | B. | 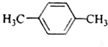 | C. | 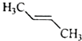 | D. | 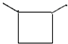 |
| A. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| B. | SO2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | pH=1的溶液中能大量共存的离子组:Fe2+、NO3-、SO42-、Na+ | |
| D. | NO可用于某些疾病的治疗 |
| A. | 3个 | B. | 8个 | C. | 9个 | D. | 18个 |
| A. | 决定反应速率的因素只有催化剂 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 锌与稀硫酸反应时,加入少量水能加快产生氢气的速率 | |
| D. | 在一定条件下2mol SO2与 1mol O2混合一定能生成2mol SO3 |
 酚
酚 酯
酯 醛
醛 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知: