题目内容
10.若从溴水中把溴萃取出来,可选用的萃取剂是( )| A. | 水 | B. | 无水酒精 | C. | 四氯化碳 | D. | 氢氧化钠溶液 |
分析 根据萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应.
解答 解:A.碘在水中的溶解度很小,且水与碘水互溶,故A错误;
B.碘在酒精中的溶解度很大,酒精与水互溶,故B错误;
C.碘在四氯化碳中的溶解度大于在水中的溶解度,且碘与四氯化碳不反应;水与四氯化碳不互溶,故C正确;
D.氢氧化钠溶液可与碘单质反应生成碘化钠和次碘酸钠,故D错误.
故选C.
点评 本题考查萃取,萃取是利用溶质在不同溶剂中溶解度的不同而分离的,应掌握萃取的条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 同一原子中,2p、3p、4p能级的轨道数依次增多 | |
| B. | 电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则 | |
| C. | 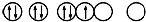 表示的原子能量处于最低状态 表示的原子能量处于最低状态 | |
| D. | 在离核最近区域内运动的电子能量最低 |
18.下列原因解释与氢键无关的( )
| A. | CH4的沸点比SiH4低,而CH4比SiH4热稳定性强 | |
| B. | 有机物大多难溶于水,而乙醇和乙酸可与水互溶 | |
| C. | H2O2和H2S的相对分子相近,而H2O2的沸点远高于H2S | |
| D. | 采用加压液化的方法从氨合成塔里分离出NH3 |
5.下列说法中正确的是( )
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 在周期表里,主族元素所在的族序数等于原子核外电子数 |
2.100mL 6mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A. | 碳酸钠(固体) | B. | 水 | C. | 硫酸钾溶液 | D. | 浓硝酸 |
19.下列反应中,反应前后溶液颜色不发生变化的是( )
| A. | 乙烯通入酸性高锰酸钾溶液 | |
| B. | 氯气用足量氢氧化钠溶液吸收 | |
| C. | 铁粉投入硫酸铜溶液 | |
| D. | 往淀粉和碘化钾的混合溶液中滴加适量的氯化铁溶液 |
20.表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;化学性质最不活泼的元素是Ar,其原子的原子结构示意图为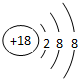 ;
;
(2)在短周期中,元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)在②⑦⑩元素中,原子半径最大的是Br,原子半径最小的是F;
(4)在③与⑨的单质中,化学性质较活泼的是K,写出其与水反应的化学方程式:2K+2H2O=2KOH+H2↑.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)在短周期中,元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)在②⑦⑩元素中,原子半径最大的是Br,原子半径最小的是F;
(4)在③与⑨的单质中,化学性质较活泼的是K,写出其与水反应的化学方程式:2K+2H2O=2KOH+H2↑.
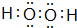 .
.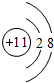 .
.