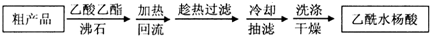题目内容
19.关于下列实验,说法正确的是( )| A. | 将一块铝片投入足量NaOH溶液中,充分反应后铝片消失,将溶液蒸干便可得到纯净NaAlO2 | |
| B. | 将二块相同铝片投入到等物质的量浓度的CuSO4和CuCl2溶液中,反应速率几乎相同 | |
| C. | 将铝粉投入浓NaOH溶液中,1mol铝可还原3mol水 | |
| D. | 将一小块钠投入盛有乙醇的烧杯中,由于钠的密度大于乙醇,所以钠一直在液面下反应 |
分析 A、过量氢氧化钠可与空气中二氧化碳反应生成碳酸钠;
B、由于两种铜盐中阴离子不同,所以反应速率不可能完全相同;
C、铝和氢氧化钠溶液的反应中,作氧化剂的是水而不是氢氧化钠,根据得失电子守恒可知;
D、由于钠和乙醇会产生氢气,所以钠在氢气的作用下,不可能一直在液面下反应.
解答 解:A、NaOH足量,与空气中二氧化碳反应,最后还可得到碳酸钠,不能得到纯净物,故D错误.
B、由于两种铜盐中阴离子不同,所以反应速率不可能完全相同,要相同必须是外界条件相同,故B错误;
C、铝和氢氧化钠溶液的反应中,作氧化剂的是水而不是氢氧化钠,而1mol铝转移3mol的电子,所以水要电离出3mol的氢离子,所以需3mol的水,故C正确;
D、由于钠和乙醇会产生氢气,所以钠在氢气的作用下,不可能一直在液面下反应,故D错误;
故选C.
点评 本题考查铝的化学性质,涉及铝与碱的反应、与盐的反应和乙醇的作用,综合性强,但比较容易.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
9.下列叙述错误的是( )
| A. | 用灼烧的方法可以鉴别羊毛和棉花 | |
| B. | 用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 | |
| C. | 用酒精清洗沾到皮肤上的苯酚 | |
| D. | 用酸性高猛酸钾溶液鉴别甲苯和苯乙烯 |
7.在标准状况下,在三个干燥的烧瓶内分别装入:纯净的NH3,含有少量空气的NH3,NO2和O2的混合气体[v(NO2):v(O2)=4:1].然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
| A. | 21:12:4 | B. | 5:5:4 | C. | 5:5:1 | D. | 无法确定 |
14.苯与乙烯相比较,下列叙述正确的是( )
| A. | 都容易发生取代反应 | B. | 都能被酸性KMnO4氧化 | ||
| C. | 苯不能发生加成反应 | D. | 都能在空气中燃烧 |
4.下列仪器的使用或操作或实验正确的是( )
| A. | 测定溶液pH的操作:将pH试纸置于表面皿上,用蒸馏水润湿,再用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量 | |
| D. | 做Al与CuSO4溶液的置换反应实验时,可将铝条直接插入CuSO4溶液中,观察铝片表面是否有铜析出 |
11.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )
| A. | 原子半径A<B<C | |
| B. | A与C可形成离子化合物 | |
| C. | A的氧化物熔点比B的氧化物高 | |
| D. | B单质可与A的最高价氧化物发生置换反应 |
9.下列实验现象与结论不一致的是
( )
| 实验操作(或设计) | 实验现象 | 结论 | |
| A | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | 酸性:HB>HA |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡 | 镁作原电池的负极 |
| C | 相同温度下,等质量的大理石与等体积等浓度的盐酸反应 | 粉状大理石产生气泡更快 | 反应速率: 粉状大理石>块状大理石 |
| D | 向盛有10滴0.1mol•L-1 AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 NaI溶液 | 先有白色沉淀,后转成黄色沉淀 | Ksp(AgCl )>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
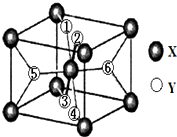 在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分. (1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略).
(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略). .
.