题目内容
7.在标准状况下,在三个干燥的烧瓶内分别装入:纯净的NH3,含有少量空气的NH3,NO2和O2的混合气体[v(NO2):v(O2)=4:1].然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )| A. | 21:12:4 | B. | 5:5:4 | C. | 5:5:1 | D. | 无法确定 |
分析 氨气极易溶于水,溶解氨气的烧瓶充满溶液,根据c=$\frac{n}{V}$计算出氨水浓度;
第二个烧瓶内含有空气,溶液不能充满烧瓶,但氨气的体积和溶液体积仍然相等;
第三个试管内发生反应的方程式为4NO2+O2+2H2O=4HNO3,根据反应计算出溶质的物质的量,溶液充满烧瓶,根据c=$\frac{n}{V}$计算出硝酸的浓度.
解答 解:设烧瓶的容积为VL,VL标况下气体的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
氨气极易溶于水,溶解氨气的烧瓶充满溶液,所以盛有氨气的烧瓶内浓度为:$\frac{\frac{V}{22.4}mol}{VL}$=:$\frac{1}{22.4}$mol/L;
第二个烧瓶内含有空气,溶液不能充满烧瓶,但氨气的体积和溶液体积仍然相等,溶液的最终浓度仍然是$\frac{1}{22.4}$mol/L;
第三个试管内发生反应的方程式为4NO2+O2+2H2O=4HNO3,反应后溶质的物质的量为:$\frac{V}{22.4}$mol×$\frac{4}{5}$,溶液体积为VL,则所得溶液的浓度是:$\frac{\frac{4V}{5×22.4}mol}{VL}$=$\frac{4}{5×22.4}$mol/L,
三个烧瓶中所得溶液的物质的量浓度之比为:$\frac{1}{22.4}$mol/L:$\frac{1}{22.4}$mol/L:$\frac{4}{5×22.4}$mol/L=5:5:4,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及计算方法为解答关键,第二个烧瓶中溶液浓度的计算为易错点,注意合理分析溶质物质的量与溶液体积的关系.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
17.常温下,向pH=2的醋酸溶液中加入少量0.01mol•L-1的盐酸,溶液中一定发生变化的是( )
| A. | c(CH3COO-) | B. | KW | C. | Ka(CH3COOH) | D. | c(H+) |
18.以下化学用语正确的是 ( )
| A. | Cr最外层电子排布式 4s2 | B. | 乙醇的结构简式CH3CH2OH | ||
| C. | 二氧化硅的分子式 SiO2 | D. | 甲醛的电子式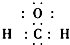 |
15.已知外电路中,电子由铜流向a极.有关图所示的装置分析合理一项是( )
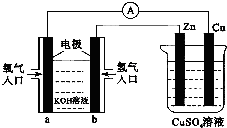

| A. | 该装置中Cu极为正极 | |
| B. | 当铜极的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L | |
| C. | b极反应的电极反应式为:H2-2e-═2H+ | |
| D. | 一段时间后锌片质量减少 |
2.下列化学用语和描述均正确的是( )
| A. | 钙原子的结构示意图: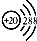 | |
| B. | 结构简式为CH2CH2的分子可发生加成反应 | |
| C. | 符号为${\;}_{8}^{18}$O的原子常用于文物年代的测定 | |
| D. | 电子式分别为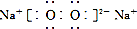 和 和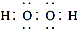 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
19.关于下列实验,说法正确的是( )
| A. | 将一块铝片投入足量NaOH溶液中,充分反应后铝片消失,将溶液蒸干便可得到纯净NaAlO2 | |
| B. | 将二块相同铝片投入到等物质的量浓度的CuSO4和CuCl2溶液中,反应速率几乎相同 | |
| C. | 将铝粉投入浓NaOH溶液中,1mol铝可还原3mol水 | |
| D. | 将一小块钠投入盛有乙醇的烧杯中,由于钠的密度大于乙醇,所以钠一直在液面下反应 |
16.1905年德国化学家哈伯发明了合成氨的方法.他因此获得了1918年度诺贝尔化学奖.哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,用铁作催化剂,且氨转化率10%-15%.2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物.用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2$\stackrel{催化剂}{?}$2NH3,有关说法正确的是( )
| A. | 不同的催化剂对化学反应速率影响均相同 | |
| B. | 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
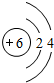 ,B与C形成的化合物的电子式为
,B与C形成的化合物的电子式为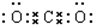 .
.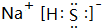 .
.