题目内容
9.下列实验现象与结论不一致的是| 实验操作(或设计) | 实验现象 | 结论 | |
| A | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | 酸性:HB>HA |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡 | 镁作原电池的负极 |
| C | 相同温度下,等质量的大理石与等体积等浓度的盐酸反应 | 粉状大理石产生气泡更快 | 反应速率: 粉状大理石>块状大理石 |
| D | 向盛有10滴0.1mol•L-1 AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 NaI溶液 | 先有白色沉淀,后转成黄色沉淀 | Ksp(AgCl )>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.等体积pH=3的HA和HB两种酸分别与足量的锌反应,HA放出气体多,则HA的浓度大;
B.镁、铝为电极,氢氧化钠为电解质的原电池装置中,Al为负极;
C.表面积越大,反应速率越大;
D.沉淀向更难溶的方向转化.
解答 解:A.等体积pH=3的HA和HB两种酸分别与足量的锌反应,HA放出气体多,则HA的浓度大,HA为弱酸,所以酸性HB>HA,故A正确;
B.镁、铝为电极,氢氧化钠为电解质的原电池装置中,Al为负极,Mg为正极,氢离子在Mg电极上得到电子生成氢气,故B错误;
C.固体表面积越大,反应速率越大,故C正确;
D.白色沉淀转化为黄色沉淀,说明生成AgI,生成物溶度积更小,则Ksp(AgCl)>Ksp(AgI),故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性比较及pH与浓度的关系、原电池、化学反应速率以及沉淀转化等,把握化学反应原理及实验中细节为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.

练习册系列答案
相关题目
19.关于下列实验,说法正确的是( )
| A. | 将一块铝片投入足量NaOH溶液中,充分反应后铝片消失,将溶液蒸干便可得到纯净NaAlO2 | |
| B. | 将二块相同铝片投入到等物质的量浓度的CuSO4和CuCl2溶液中,反应速率几乎相同 | |
| C. | 将铝粉投入浓NaOH溶液中,1mol铝可还原3mol水 | |
| D. | 将一小块钠投入盛有乙醇的烧杯中,由于钠的密度大于乙醇,所以钠一直在液面下反应 |
14.如图为某原电池的示意图,下列说法正确的是( )
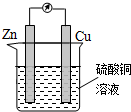

| A. | 铜片作负极 | B. | 溶液的颜色逐渐变浅 | ||
| C. | 电子由铜棒流出 | D. | 锌片上发生还原反应 |
1.现有X、Y、Z、W四种无色溶液,分别是HCl、Ba(NO3)2、Na2CO3、AgNO3中的一种.两两之间相互反应的现象(沉淀↓、气体↑)如表所示:试判断溶液X、Y、Z、W依次是( )
| X | Y | Z | W | |
| Y | ↑ | - | ↓ | 无明显现象 |
| Z | ↓ | ↓ | - | 无明显现象 |
| A. | HCl、Na2CO3、AgNO3、Ba(NO3)2 | B. | Na2CO3、HCl、Ba(NO3)2、AgNO3 | ||
| C. | Na2CO3、HCl、AgNO3、Ba(NO3)2 | D. | AgNO3、Ba(NO3)2、HCl、Na2CO3 |
2.以下说法正确的是( )
| A. | 金属钠着火时可以用泡沫灭火器灭火 | |
| B. | 氯气可用于自来水的消毒 | |
| C. | 钠比铜活泼,因而钠可以从CuCl2溶液中置换出铜 | |
| D. | 氢氧化钠常用于治疗胃酸过多 |
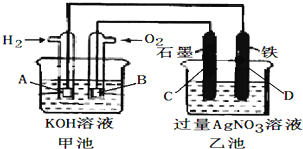
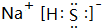 .
.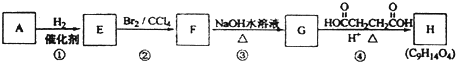
 .
. .
. .C的一氯代物只有一种(不考虑立体异构),则C的结构简式为
.C的一氯代物只有一种(不考虑立体异构),则C的结构简式为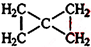 .
.