题目内容
11.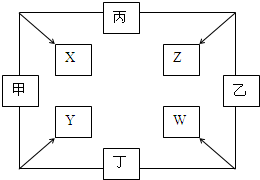 甲、乙、丙、丁四种单质在点燃条件下反应,可分别生成X、Y、Z、W四种化合物,其转化关系如图所示.已知:①甲、乙、丙为短周期元素的单质,通常状况下为气体;丁是生活中常见金属.②通常状况下,X是无色液体,Y是黑色晶体.③丙在乙中燃烧发出苍白色火焰.
甲、乙、丙、丁四种单质在点燃条件下反应,可分别生成X、Y、Z、W四种化合物,其转化关系如图所示.已知:①甲、乙、丙为短周期元素的单质,通常状况下为气体;丁是生活中常见金属.②通常状况下,X是无色液体,Y是黑色晶体.③丙在乙中燃烧发出苍白色火焰.(1)丁与X反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;红热的丁和乙反应的现象为铁在氯气中燃烧,生成棕黄色烟.
(2)常温下,若Z、W两溶液的pH均等于5,则由水电离出的H+的物质的量浓度前者与后者的比值为10-4.
(3)将少量W的饱和溶液滴入沸腾的X中,得到红褐色液体,反应的离子方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,此液体具有的性质是a、b、d(填字母).
a.光束通过该液体时形成光亮的“通路”
b.插入电极通过直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成.
分析 根据甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,甲、乙、丙均为前三周期元素的单质,常温下均为气态,甲和丙反应产生X,X是无色液体,因此X是水,是氢气和氧气反应产生的水;丁是日常生活中的一种常见金属常温下,丁和甲反应产生Y,Y是黑色固体,因此是铁和氧气反应产生四氧化三铁,则丁是四氧化三铁;由此可知甲是氧气,丙是氢气,丁是铁;丙在乙中燃烧发出苍白色的火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色,可知乙是氯气,W为氯化铁,Z为氯化氢,据此分析完成相关的问题.
解答 解:甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,甲、乙、丙均为前三周期元素的单质,常温下均为气态,甲和丙反应产生X,X是无色液体,因此X是水,是氢气和氧气反应产生的水;丁是日常生活中的一种常见金属常温下,丁和甲反应产生Y,Y是黑色固体,因此是铁和氧气反应产生四氧化三铁,则丁是四氧化三铁;由此可知甲是氧气,丙是氢气,丁是铁;丙在乙中燃烧发出苍白色的火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色,可知乙是氯气,W为氯化铁,Z为氯化氢,带入验证符合转化关系,因此:
(1)丁是铁,X是水,乙是氯气,丁与X反应的化学方程式为 3 Fe+4 H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4 H2,红热的丁和乙反应的现象为铁在氯气中燃烧,生成棕黄色烟,
故答案为:3 Fe+4 H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4 H2;铁在氯气中燃烧,生成棕黄色烟;
(2)W为氯化铁,Z为氯化氢,氯化铁溶液中若pH等于5,则由水电离出的H+的物质的量浓度为10-5mol/L,氯化氢溶液中若pH等于5,则由水电离出的H+的物质的量浓度为10-9mol/L,所以Z、W两溶液的则由水电离出的H+的物质的量浓度前者与后者的比值为10-9mol/L:10-5mol/L=10-4,
故答案为:10-4;
(3)将少量氯化铁的饱和溶液滴入沸腾的水中,得到红褐色液体,反应的离子方程式为Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3H+,此液体为胶体,所以有
a.光束通过该液体时形成光亮的“通路”,是胶体的丁达尔现象,故正确;
b.插入电极通过直流电后,有一极附近液体颜色加深,是胶体的电泳,现象,故正确;
c.向该液体中加入硝酸银溶液,溶液中有氯离子,有沉淀产生,故错误;
d.将该液体加热、蒸干、灼烧后,铁离子充分水解,氯化氢挥发,有氧化铁生成,故正确,
故答案为:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3H+;a、b、d.
点评 本题考查无机物的推断,为高考常见框图推断,综合考查元素化合物知识,侧重氯及其化合物、铁及其化合物及化学反应原理的考查,利用信息及转化推出各物质为解答的关键,注意颜色和状态为解答的突破口,题目难度中等.

| A. | 都正确 | B. | 都不正确 | C. | 甲正确,乙不正确 | D. | 都对或都错 |
| A. | Fe2O3+6HCl→2FeCl3+3H2O | B. | 3Fe+4H2O→Fe3O4+4H2↑ | ||
| C. | 2FeCl3+2KI→2FeCl2+I2+2KCl | D. | 3NaOH+FeCl3→Fe(OH)3↓+3NaCl |
| A. | 1mol H2与0.5 mol H2和O2的混合物所含的原子数目相同 | |
| B. | 16 g O2含有6.02×1023个氧分子 | |
| C. | 1 mol H2O中含有2 mol H2,1molO,总共所含电子的物质的量为10 mol | |
| D. | 物质的量为1 mol的任何微粒的质量与NA个该种微粒的质量在任何情况下都相等 |
| A. | 电解池的阳极发生氧化反应,阴极发生还原反应 | |
| B. | 电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气 | |
| C. | 电解法精炼粗铜,用纯铜作阴极 | |
| D. | 在镀件上电镀锌时,用锌作阳极 |
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,不能等到混合物中的水分完全蒸干后,才停止加热 |
| A. | 参加化学反应的各物质的总质量等于反应后生成的各物质的总质量 | |
| B. | 化合物中元素化合价的正价总数与负价总数的数值相等 | |
| C. | 溶液稀释前后溶质的质量相等 | |
| D. | 在原子中原子核内的质子数和中子数相等 |
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):