题目内容
19.下列叙述中正确的是( )| A. | 1mol H2与0.5 mol H2和O2的混合物所含的原子数目相同 | |
| B. | 16 g O2含有6.02×1023个氧分子 | |
| C. | 1 mol H2O中含有2 mol H2,1molO,总共所含电子的物质的量为10 mol | |
| D. | 物质的量为1 mol的任何微粒的质量与NA个该种微粒的质量在任何情况下都相等 |
分析 A.1mol H2中含2mol原子,0.5 mol H2和O2中含1mol原子;
B.结合n=$\frac{m}{M}$、N=nNA计算;
C.水中不含氢气;
D.NA个微粒为1mol.
解答 解:A.1mol H2中含2mol原子,0.5 mol H2和O2中含1mol原子,则原子数目不同,故A错误;
B.由n=$\frac{m}{M}$、N=nNA可知,16 g O2含有氧分子为$\frac{16g}{32g/mol}$×6.02×1023个,故B错误;
C.水中不含氢气,则1 mol H2O中含有2 mol H、1molO,总共所含电子的物质的量为1mol×(2+8)=10 mol,故C错误;
D.NA个微粒为1mol,即物质的量为1 mol的任何微粒的质量与NA个该种微粒的质量在任何情况下都相等,故D正确;
故选D.
点评 本题考查物质的量的计算,为高频考点,把握物质的量的相关计算公式及分子构成为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
10.下列关于有机物的说法或表述中不正确的是( )
| A. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| B. | 可借助于核磁共振氢谱区分乙醇和二甲醚这两种物质 | |
| C. | CH3CH(CH3)CH(CH3)CH(C2H5)CH2CH3的名称:2,3-二甲基-4-乙基己烷 | |
| D. | 石油裂解是高分子生成小分子的过程 |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 mol 苯乙烯中含有的碳碳双键数为4NA | |
| B. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| C. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| D. | 足量的Fe和1mol Cl2完全反应,转移的电子数为3NA |
7.某溶液中存在较多的H+、S${O}_{4}^{2-}$,则溶液中还可能大量存在的离子组是( )
| A. | Al3+、CH3COO-、Cl- | B. | Mg2+、Ba2+、N${O}_{3}^{-}$ | ||
| C. | Cl-、Ca2+、Na+ | D. | N${H}_{4}^{+}$、Cl-、Mg2+ |
14.25℃时,弱酸的电离平衡常数如下表:
下列有关说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
| A. | 等物质的量浓度的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol/L HCN与a mol/L NaOH溶液等体积混合后所得溶液呈中性 | |
| C. | 往冰醋酸中逐滴加水稀释,溶液导电能力始终保持减小 | |
| D. | 等浓度Na2CO3溶液的碱性比NaHCO3溶液的碱性强 |
4.下列各组中互为同位素的是( )
| A. | O2和O3 | B. | H2和D2 | C. | CH4和C3H8 | D. | 2He和3He |
6.下列离子方程式中书写正确的是( )
| A. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铁与稀硫酸的反应:Fe+2H+═Fe3++H2↑ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
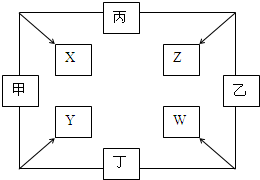 甲、乙、丙、丁四种单质在点燃条件下反应,可分别生成X、Y、Z、W四种化合物,其转化关系如图所示.已知:①甲、乙、丙为短周期元素的单质,通常状况下为气体;丁是生活中常见金属.②通常状况下,X是无色液体,Y是黑色晶体.③丙在乙中燃烧发出苍白色火焰.
甲、乙、丙、丁四种单质在点燃条件下反应,可分别生成X、Y、Z、W四种化合物,其转化关系如图所示.已知:①甲、乙、丙为短周期元素的单质,通常状况下为气体;丁是生活中常见金属.②通常状况下,X是无色液体,Y是黑色晶体.③丙在乙中燃烧发出苍白色火焰.