题目内容
18. 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):(1)对于氢氧燃料电池,下列叙述不正确的是CD.
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-═4OH-
C.电池总反应式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)如图右边装置中盛有AgNO3溶液,当氢氧燃料电池工作一段时间后,AgNO3溶液的pH减小(填“增大”、“减小”或“不变”).
(3)已知甲醇的燃烧热△H=-726.5kJ/mol,在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为CH3OH+H2O-6e-═CO2+6H+,正极的反应式为$\frac{3}{2}$O2+6H++6e-═3H2O.
理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为96.6%(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比).
分析 (1)氢氧燃料电池工作时,通入氢气的电极为负极,发生氧化反应,在碱性溶液中,电极方程式为H2-2e-+2OH-=2H2O,通入氧气的电极为正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,总反应式为2H2+O2=2H2O,电解硝酸银溶液,pH减小;
(2)电解硝酸银溶液,阴极发生4Ag++4e-=4Ag,阳极发生4OH--4e-=2H2O+O2↑,总反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+O2↑+4Ag,根据方程式计算;
(3)甲醇燃料电池,甲醇在负极失电子发生氧化反应,氧气在正极放电,酸性条件下生成水;
根据甲醇的燃烧热计算2mol甲醇完全燃烧放出的热量,结合原电池产生的电能计算.
解答 解:(1)A、a电极通入氢气,发生氧化反应,应是负极,原电池工作时OH-移向负极,故A正确;
B、通入氧气的电极为正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故B正确;
C、电极总反应式为2H2+O2=2H2O,不是在点燃的条件下反应,故C错误;
D、电解硝酸银溶液总反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+O2↑+4Ag,电池中电解质溶液的pH减小,故D错误;
E、氢氧燃料电池可分别在两级上通入氢气和氧气,是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置,故E正确.
故答案为:CD;
(2)电解硝酸银溶液,阴极发生4Ag++4e-=4Ag,阳极发生4OH--4e-=2H2O+O2↑,总反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+O2↑+4Ag,所以电解一段时间后溶液pH减小,故答案为:减小;
(2)酸性条件下甲醇燃料电池的总反应式为:CH3OH+$\frac{3}{2}$O2═CO2+2H2O①,酸性条件下该燃料电池的正极反应式为$\frac{3}{2}$O2+6H++6e-═3H2O②,①-②得电池负极反应式为:CH3OH+H2O-6e-═CO2+6H+;该燃料电池的理论效率为$\frac{702.1KJ}{726.5KJ}$×100%=96.6%.
故答案为:CH3OH+H2O-6e-═CO2+6H+;$\frac{3}{2}$O2+6H++6e-═3H2O;96.6%.
点评 本题考查电化学知识,为高考常见题型,侧重于考查学生综合运用化学知识的能力和分析问题的能力,明确正负极、阴阳极上得失电子是解本题关键,难点是电极反应式的书写,题目难度中等.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 1 mol 苯乙烯中含有的碳碳双键数为4NA | |
| B. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| C. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| D. | 足量的Fe和1mol Cl2完全反应,转移的电子数为3NA |
| A. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铁与稀硫酸的反应:Fe+2H+═Fe3++H2↑ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
| A. | 二氧化碳不但易溶于水,而且能与水发生反应 | |
| B. | 一氧化碳有毒,冬天燃煤取暖要防止煤气中毒 | |
| C. | 木炭具有吸附性,可以除去冰箱中的异味 | |
| D. | 氧气化学性质活泼,能与很多单质以及化合物发生化学反应 |
| A. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 | |
| B. | 分别加水稀释100倍后,两种溶液的c(H+)不再相等 | |
| C. | 中和同体积的这两种酸性溶液所需要NaOH的物质的量相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相等 |
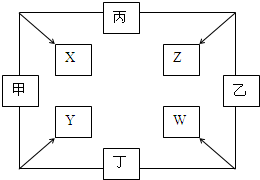 甲、乙、丙、丁四种单质在点燃条件下反应,可分别生成X、Y、Z、W四种化合物,其转化关系如图所示.已知:①甲、乙、丙为短周期元素的单质,通常状况下为气体;丁是生活中常见金属.②通常状况下,X是无色液体,Y是黑色晶体.③丙在乙中燃烧发出苍白色火焰.
甲、乙、丙、丁四种单质在点燃条件下反应,可分别生成X、Y、Z、W四种化合物,其转化关系如图所示.已知:①甲、乙、丙为短周期元素的单质,通常状况下为气体;丁是生活中常见金属.②通常状况下,X是无色液体,Y是黑色晶体.③丙在乙中燃烧发出苍白色火焰. .
.