题目内容
14.在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L-1.请填空:①x=1,②B的转化率为40%.
③温度降低,K值增大,则正反应是放热(填“放热”或“吸热”)反应.
④能判断该反应达到平衡状态的依据是BC(填编号)
A、混合气体的密度不变
B、容器中的压强不再变化
C、生成D的反应速率是生成B的反应速率的2倍
D、单位时间内生成3molA,同时生成1molB
⑤在其他条件不变的情况下,将原容器体积扩大到4L,下列有关该体系的说法正确的是AD(填编号)
A、B的浓度减少
B、正反应速率加快,逆反应速率也加快
C、C的物质的量增加
D、重新平衡时$\frac{n(A)}{n(C)}$增大.
分析 ①计算出C的物质的量,利用C、D物质的量之比等于化学计量数之比求x;
②根据C求出转化的B的物质的量,利用转化率定义计算;
③温度降低,K值增大,说明平衡向正反应方向移动,降低温度向放热反应方向移动;
④可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
⑤在其他条件不变的情况下,将原容器体积扩大到4L,3A(g)+B(g)?C(g)+2D(g),反应是气体体积减小的反应,压强减小平衡逆向进行;
解答 解:①平衡时,n(C)=2L×0.2mol•L-1=0.4mol,
利用C、D物质的量之比等于化学计量数之比,则:
x:2=0.4mol:0.8mol,解得x=1,
故答案为:1;
②平衡时,n(C)=0.4mol,由方程式3A(g)+B(g)?C(g)+2D(g)可知,转化的B的物质的量n(B)=n(C)=0.4mol,所以B的转化率α=$\frac{0.4mol}{1mol}$×100%=40%.
故答案为;40%;
③温度降低,K值增大,说明平衡向正反应方向移动,降低温度向放热反应方向移动,所以正反应为放热反应.
故答案为:放热;
④A、反应混合物都为气体,根据质量守恒,混合气体的总质量不变,体积为定值,密度自始至终不变,不能说明到达平衡状态,故A错误;
B、反应为反应前后气体体积减小的反应,固定容积的密闭容器,容器中的压强不再变化,说明气体的总物质的量不再发生变化,说明到达平衡状态,故B正确;
C、生成D的反应速率表示正反应速率,生成B的反应速率表示逆反应速率,正逆反应速率之比等于系数之比(不同物质),说明达到平衡状态,故C正确;
D、都表示逆反应速率,自始至终都按2molA:1molB进行反应,不能说明到达平衡状态,故D错误;
故答案为:BC.
⑤在其他条件不变的情况下,将原容器体积扩大到4L,3A(g)+B(g)?C(g)+2D(g),反应是气体体积减小的反应,压强减小平衡逆向进行,
A、体积增大为原来的一倍,尽管平衡逆向进行,但体积变化为主,B的浓度减小,故A正确;
B、体积增大为原来的一倍,压强减小,正反应速率减小,逆反应速率也减小,故B错误;
C、平衡逆向进行C物质的量减小,故C错误;
D、体积增大为原来的一倍,压强减小,平衡逆向进行,重新平衡时$\frac{n(A)}{n(C)}$增大,故D正确;
故答案为:AD;
点评 本题考查了化学平衡影响因素分析,反应速率计算应用,当能用某个量来判断可逆反应达到了化学平衡状态时,该量应该具备的特点是:先变后不变(区分非平衡状态和平衡状态),要把握住这个特点来分析,这也要求我们在学习时要善于总结解题规律,题目难度中等.

| A. | Al3+、CH3COO-、Cl- | B. | Mg2+、Ba2+、N${O}_{3}^{-}$ | ||
| C. | Cl-、Ca2+、Na+ | D. | N${H}_{4}^{+}$、Cl-、Mg2+ |
| A. | O2和O3 | B. | H2和D2 | C. | CH4和C3H8 | D. | 2He和3He |
| A. | 分子数之比为1:1 | B. | 原子总数之比为1:1 | ||
| C. | SO2和SO3的质量比为1:1 | D. | 氧元素的质量比为1:1 |
| A. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铁与稀硫酸的反应:Fe+2H+═Fe3++H2↑ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
 .
. .
.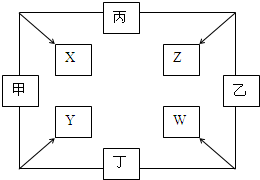 甲、乙、丙、丁四种单质在点燃条件下反应,可分别生成X、Y、Z、W四种化合物,其转化关系如图所示.已知:①甲、乙、丙为短周期元素的单质,通常状况下为气体;丁是生活中常见金属.②通常状况下,X是无色液体,Y是黑色晶体.③丙在乙中燃烧发出苍白色火焰.
甲、乙、丙、丁四种单质在点燃条件下反应,可分别生成X、Y、Z、W四种化合物,其转化关系如图所示.已知:①甲、乙、丙为短周期元素的单质,通常状况下为气体;丁是生活中常见金属.②通常状况下,X是无色液体,Y是黑色晶体.③丙在乙中燃烧发出苍白色火焰. .
.