题目内容
3.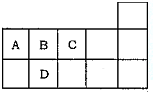 如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )| A. | 原子半径大小比较为D>A>B>C | |
| B. | A与C形成的阴离子可能有AC22-,A2C42- | |
| C. | 生成的氢化物分子间均可形成氢键 | |
| D. | A,B,C,D的单质常温下均不导电 |
分析 由短周期元素在周期表中位置,可知A为碳、B为N、C为O、D为P.
A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.碳、氧元素可以形成碳酸根、草酸根;
C.碳、磷的氢化物分子间不能形成氢键;
D.石墨可以导电.
解答 解:由短周期元素在周期表中位置,可知A为碳、B为N、C为O、D为P.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:D>A>B>C,故A正确;
B.碳、氧元素可以形成CO32-、C2O42-,故B错误;
C.氨气分子之间、水分子之间可以形成氢键,但碳的氢化物、磷的氢化物分子间不能形成氢键,故C错误;
D.石墨可以导电,故D错误,
故选:A.
点评 本题考查元素周期表与元素周期律,难度不大,熟练掌握元素周期律的结构,侧重对基础知识的巩固.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
13.某兴趣小组为研究电池原理,设计如图装置.以下叙述不正确的是( )
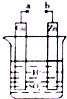

| A. | a和b不连接时,无电流产生,Zn片表面有气泡逸出 | |
| B. | a和b用导线连接,有电流产生,Cu片表面有气泡逸出 | |
| C. | 无论a和b是否连接,Zn片均被腐蚀,溶液的pH均减小 | |
| D. | 若将装置中H2SO4溶液换成CuSO4溶液仍然可以设计成原电池 |
14.科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性质进行深入研究.下列各组物质中有一种物质从化学性质角度看与其它物质不属于同一类,请将其挑出来,并说明余下的物质属于哪一类.
| 物质组 | 不属于同类的物质 | 余下的物质属于哪一类物质 |
| (1)MgO、CaO、Na2O、AL2O3 | Al2O3 | 碱性氧化物 |
| (2)CO、CO2、SO2、SiO2 | CO | 酸性氧化物 |
| (3)HClO、H2SO4、HNO3、H3PO4 | H3PO4 | 强酸 |
11.解释下列事实的离子方程式不正确的是( )
| A. | Cu与浓H2SO4反应放出气体:Cu+2H+═Cu2++H2↑ | |
| B. | 用大理石与稀盐酸制备CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-═BaSO4↓ | |
| D. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |
18.下列变化需要加入适当的氧化剂才能完成的是( )
| A. | Fe→Fe3O4 | B. | HNO3→NO | C. | H2SO4 →CuSO4 | D. | Na2O→NaOH |
8.为达到相应的实验目的,下列实验的设计或操作最合理的是( )
| A. | 为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用酚酞作指示剂,用标准盐酸溶液滴定 | |
| B. | 为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部 | |
| C. | 为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值 | |
| D. | 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水 |
5.已知反应nA(g)?An(g)的平衡常数为K,则有$\frac{1}{2}$An(g)?$\frac{1}{2}$nA(g)的平衡常数是( )
| A. | K | B. | K${\;}^{-\frac{1}{2}}$ | C. | K2 | D. | K-2 |
6.下列各组中的金属,还原性依次减弱的是( )
| A. | Na,Al,Fe | B. | Zn,Cu,Al | C. | Ca,Na,K | D. | Zn、Ca,Al |