题目内容
5.已知反应nA(g)?An(g)的平衡常数为K,则有$\frac{1}{2}$An(g)?$\frac{1}{2}$nA(g)的平衡常数是( )| A. | K | B. | K${\;}^{-\frac{1}{2}}$ | C. | K2 | D. | K-2 |
分析 化学平衡常数指,一定温度下,可逆达到平衡,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故对于同一可逆反应,相同温度下,正、逆两个方向的平衡常数互为倒数,同一可逆反应,平衡常数与系数成对应幂次方关系.
解答 解:对于同一可逆反应,相同温度下,正、逆两个方向的平衡常数互为倒数,已知反应nA(g)?An(g)的平衡常数为K,则有An(g)?nA(g)的平衡常数$\frac{1}{K}$,又同一可逆反应,平衡常数与系数成对应幂次方关系,所以$\frac{1}{2}$An(g)?$\frac{1}{2}$nA(g)的平衡常数为$\sqrt{\frac{1}{K}}$=K${\;}^{-\frac{1}{2}}$.
故选B.
点评 本题考查平衡常数的书写、计算等,比较基础,掌握平衡常数的书写与意义即可解答.

练习册系列答案
相关题目
3.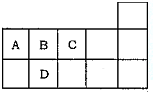 如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
 如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )| A. | 原子半径大小比较为D>A>B>C | |
| B. | A与C形成的阴离子可能有AC22-,A2C42- | |
| C. | 生成的氢化物分子间均可形成氢键 | |
| D. | A,B,C,D的单质常温下均不导电 |
13.短周期元素X、Y、Z原子序数依次递增且原子序数和为32,Y、Z在同一周期但不相邻,Z的最外层电子数等于其电子层数.下列有关叙述不正确的是( )
| A. | X、Y两元素能形成阴阳离子个数比都是1:2的化合物Y2X、Y2X2 | |
| B. | Z的简单离子在同周期元素所形成的简单离子中半径最小,Z的最高价氧化物对应的水化物既能与强酸反应又能与强碱反应 | |
| C. | Y、Z所在周期的所有元素中Y的金属性最强,工业上通过电解其熔融氯化物得到Y单质 | |
| D. | X元素形成的单质存在同素异形现象,其中以X2单质最为常见且氧化性最强 |
17.下列描述中,不符合生产实际的是( )
| A. | 工业电解饱和食盐水,阳离子交换膜的作用是使得阴极区的OH -不能进入阳极区 | |
| B. | 电解法精炼铜用纯铜作阴极,阳极泥中可能含有金、银等贵重金属. | |
| C. | 在镀件上电镀锌,用锌作阳极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
14.从2L物质的量浓度为1mol/L 的NaOH溶液中取出100mL溶液,下面关于这 100mL溶液的叙述错误的是( )
| A. | NaOH的物质的量浓度为0.1mol/L | B. | Na+ 的物质的量浓度为1mol/L | ||
| C. | 含4g氢氧化钠 | D. | 含0.1mol NaOH |
15.下列物质的制备方法正确的是( )
| A. | 用铝粉和MnO2制得锰 | |
| B. | 用电解熔融氯化铝的方法制得单质铝 | |
| C. | 氯化铝溶液和过量氢氧化钠溶液反应制备Al(OH)3 | |
| D. | 用镁粉和空气反应制备Mg3N2 |
