题目内容
14.科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性质进行深入研究.下列各组物质中有一种物质从化学性质角度看与其它物质不属于同一类,请将其挑出来,并说明余下的物质属于哪一类.| 物质组 | 不属于同类的物质 | 余下的物质属于哪一类物质 |
| (1)MgO、CaO、Na2O、AL2O3 | Al2O3 | 碱性氧化物 |
| (2)CO、CO2、SO2、SiO2 | CO | 酸性氧化物 |
| (3)HClO、H2SO4、HNO3、H3PO4 | H3PO4 | 强酸 |
分析 (1)碱性氧化物是能和酸反应生成盐和水的氧化物,既能和酸反应又能和碱反应均生成盐和水氧化物,属于两性氧化物,Al2O3 是两性氧化物;
(2)酸性氧化物是能和碱反应生成盐和水的氧化物,既不能和酸又不能和碱反应生成盐和水的氧化物是不成盐氧化物,CO是不成盐氧化物;
(3)完全电离的酸是强酸,部分电离的是弱酸,H3PO4是弱酸.
解答 解:(1)依据氧化物的性质判断,MgO、CaO、Na2O都是碱性氧化物,Al2O3是两性氧化物;
(2)依据氧化物的性质分析,CO2、SO2、SiO2 都是酸性氧化物,CO是不成盐氧化物;
(3)分析溶液中性质判断,HCl、H2SO4、HNO3都是强酸,H3PO4是弱酸;
故答案为:
| 不属于同类物质 | 其他物质属于哪一类物质 |
| Al2O3 | 碱性氧化物 |
| CO | 酸性氧化物 |
| H3PO4 | 强酸 |
点评 本题考查了物质的分类,理解概念实质和分类是解题关键,题目难度不大.

练习册系列答案
相关题目
4.下列有关浓硫酸的叙述完全正确的一组是:( )
①浓硫酸具有强氧化性,SO2具有强还原性,所以浓硫酸不能干燥SO2气体
②浓硫酸与铜加热反应后,铜片有剩余,硫酸反应完全
③浓硫酸具有脱水性,因而能使蔗糖、纸张等炭化
④浓硫酸与铁加热反应后,铁片有剩余,生成的气体中除水蒸气外只有氢气
⑤浓硫酸在常温下能使用铁制或铝制容器盛放.
①浓硫酸具有强氧化性,SO2具有强还原性,所以浓硫酸不能干燥SO2气体
②浓硫酸与铜加热反应后,铜片有剩余,硫酸反应完全
③浓硫酸具有脱水性,因而能使蔗糖、纸张等炭化
④浓硫酸与铁加热反应后,铁片有剩余,生成的气体中除水蒸气外只有氢气
⑤浓硫酸在常温下能使用铁制或铝制容器盛放.
| A. | ①③⑤ | B. | ③⑤ | C. | ②③④ | D. | ①④⑤ |
5.下列生活常见现象中,没有涉及化学变化的是( )
| A. | 海水晒盐 | B. | 钢铁生锈 | C. | 食物腐败 | D. | 木材燃烧 |
19.实验室某试剂瓶上有如下标志: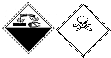 该标志的含义是( )
该标志的含义是( )
 该标志的含义是( )
该标志的含义是( )| A. | 自燃物品、有毒 | B. | 腐蚀品、有毒 | C. | 爆炸性、腐蚀品 | D. | 腐蚀品、氧化剂 |
6.当光束通过下列分散系时能观察到丁达尔效应的是( )
①氯化钠溶液 ②CuSO4溶液 ③硅酸胶体 ④Fe(OH)3胶体.
①氯化钠溶液 ②CuSO4溶液 ③硅酸胶体 ④Fe(OH)3胶体.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
3.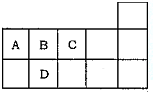 如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
 如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )| A. | 原子半径大小比较为D>A>B>C | |
| B. | A与C形成的阴离子可能有AC22-,A2C42- | |
| C. | 生成的氢化物分子间均可形成氢键 | |
| D. | A,B,C,D的单质常温下均不导电 |
17.下列描述中,不符合生产实际的是( )
| A. | 工业电解饱和食盐水,阳离子交换膜的作用是使得阴极区的OH -不能进入阳极区 | |
| B. | 电解法精炼铜用纯铜作阴极,阳极泥中可能含有金、银等贵重金属. | |
| C. | 在镀件上电镀锌,用锌作阳极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
