题目内容
8.为达到相应的实验目的,下列实验的设计或操作最合理的是( )| A. | 为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用酚酞作指示剂,用标准盐酸溶液滴定 | |
| B. | 为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部 | |
| C. | 为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值 | |
| D. | 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水 |
分析 A.为酸滴定碱,选择酚酞作指示剂,反应终点与指示剂的变色范围接近;
B.应用坩埚钳夹持燃烧,不能投入上述集气瓶底部;
C.比较非金属性强弱,应用最高价含氧酸的酸性进行比较;
D.不能直接向试管中加入适量水,浓硫酸剩余时加水放出大量的热可导致液滴飞溅.
解答 解:A.为酸滴定碱,选择酚酞作指示剂,反应终点与指示剂的变色范围接近,则测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用酚酞作指示剂,用标准盐酸溶液滴定,故A正确;
B.在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持在中低部燃烧,不能投入上述集气瓶底部,否则易导致集气瓶底部受高温炸裂,故B错误;
C.测定相同浓度的NaCl溶液和Na2S溶液的pH值,可比较盐酸与氢硫酸的酸性,但不能比较Cl、S的非金属性,故C错误;
D.不能直接向试管中加入适量水,浓硫酸剩余时加水放出大量的热可导致液滴飞溅,则取反应后的白色固体在烧杯中加水溶解观察是否变为蓝色,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及中和滴定实验、非金属比较、燃烧、盐类水解以及物质检验等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
5.下列生活常见现象中,没有涉及化学变化的是( )
| A. | 海水晒盐 | B. | 钢铁生锈 | C. | 食物腐败 | D. | 木材燃烧 |
6.当光束通过下列分散系时能观察到丁达尔效应的是( )
①氯化钠溶液 ②CuSO4溶液 ③硅酸胶体 ④Fe(OH)3胶体.
①氯化钠溶液 ②CuSO4溶液 ③硅酸胶体 ④Fe(OH)3胶体.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
3.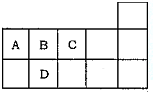 如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
 如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )| A. | 原子半径大小比较为D>A>B>C | |
| B. | A与C形成的阴离子可能有AC22-,A2C42- | |
| C. | 生成的氢化物分子间均可形成氢键 | |
| D. | A,B,C,D的单质常温下均不导电 |
3.可以用来鉴别乙烷和乙烯,还可以用来除去乙烷中乙烯的操作方法是( )
| A. | 将混合气体通过盛有浓硫酸的洗气瓶 | |
| B. | 将混合气体通过盛有水的洗气瓶 | |
| C. | 将混合气体通过盛有足量溴水的洗气瓶 | |
| D. | 将混合气体通过盛有澄清石灰水的洗气瓶 |
13.短周期元素X、Y、Z原子序数依次递增且原子序数和为32,Y、Z在同一周期但不相邻,Z的最外层电子数等于其电子层数.下列有关叙述不正确的是( )
| A. | X、Y两元素能形成阴阳离子个数比都是1:2的化合物Y2X、Y2X2 | |
| B. | Z的简单离子在同周期元素所形成的简单离子中半径最小,Z的最高价氧化物对应的水化物既能与强酸反应又能与强碱反应 | |
| C. | Y、Z所在周期的所有元素中Y的金属性最强,工业上通过电解其熔融氯化物得到Y单质 | |
| D. | X元素形成的单质存在同素异形现象,其中以X2单质最为常见且氧化性最强 |
17.下列描述中,不符合生产实际的是( )
| A. | 工业电解饱和食盐水,阳离子交换膜的作用是使得阴极区的OH -不能进入阳极区 | |
| B. | 电解法精炼铜用纯铜作阴极,阳极泥中可能含有金、银等贵重金属. | |
| C. | 在镀件上电镀锌,用锌作阳极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
18.元素R的阴离子Rn-核外有x个电子,其核内的中子数为m,则R的质量数是( )
| A. | x-n | B. | m-x+n | C. | m+x-n | D. | x+n |