题目内容
11.解释下列事实的离子方程式不正确的是( )| A. | Cu与浓H2SO4反应放出气体:Cu+2H+═Cu2++H2↑ | |
| B. | 用大理石与稀盐酸制备CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-═BaSO4↓ | |
| D. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |
分析 A.反应生成硫酸铜、二氧化硫和水;
B.反应生成氯化钙、水和二氧化碳;
C.反应生成硫酸钡和盐酸;
D.反应生成硅酸钠、水.
解答 解:A.浓硫酸具有强氧化性,则Cu与浓H2SO4反应放出气体的离子反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO42-+SO2↑+2H2O,故A错误;
B.用大理石与稀盐酸制备CO2的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故B正确;
C.稀H2SO4与BaCl2溶液反应生成沉淀的离子反应为Ba2++SO42-═BaSO4↓,故C正确;
D.盛放NaOH溶液的试剂瓶不能用玻璃塞的离子反应为SiO2+2OH-═SiO32-+H2O,故D正确;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意电子、电荷守恒的分析及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
1.下列反应的离子方程式正确的是( )
| A. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH-$\stackrel{△}{→}$CH3COO-+CH3CH2O-+H2O | |
| B. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 乙醛溶液与新制氢氧化铜碱性悬浊液共热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$ CH3COO-+Cu2O↓+3H2O |
19.实验室某试剂瓶上有如下标志: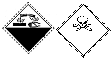 该标志的含义是( )
该标志的含义是( )
 该标志的含义是( )
该标志的含义是( )| A. | 自燃物品、有毒 | B. | 腐蚀品、有毒 | C. | 爆炸性、腐蚀品 | D. | 腐蚀品、氧化剂 |
6.当光束通过下列分散系时能观察到丁达尔效应的是( )
①氯化钠溶液 ②CuSO4溶液 ③硅酸胶体 ④Fe(OH)3胶体.
①氯化钠溶液 ②CuSO4溶液 ③硅酸胶体 ④Fe(OH)3胶体.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
3.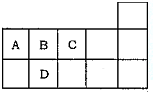 如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
 如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )
如图为元素周期表短周期的一部分,下列有关A,B,C,D四种元素的叙述正确的是( )| A. | 原子半径大小比较为D>A>B>C | |
| B. | A与C形成的阴离子可能有AC22-,A2C42- | |
| C. | 生成的氢化物分子间均可形成氢键 | |
| D. | A,B,C,D的单质常温下均不导电 |
13.短周期元素X、Y、Z原子序数依次递增且原子序数和为32,Y、Z在同一周期但不相邻,Z的最外层电子数等于其电子层数.下列有关叙述不正确的是( )
| A. | X、Y两元素能形成阴阳离子个数比都是1:2的化合物Y2X、Y2X2 | |
| B. | Z的简单离子在同周期元素所形成的简单离子中半径最小,Z的最高价氧化物对应的水化物既能与强酸反应又能与强碱反应 | |
| C. | Y、Z所在周期的所有元素中Y的金属性最强,工业上通过电解其熔融氯化物得到Y单质 | |
| D. | X元素形成的单质存在同素异形现象,其中以X2单质最为常见且氧化性最强 |
14.从2L物质的量浓度为1mol/L 的NaOH溶液中取出100mL溶液,下面关于这 100mL溶液的叙述错误的是( )
| A. | NaOH的物质的量浓度为0.1mol/L | B. | Na+ 的物质的量浓度为1mol/L | ||
| C. | 含4g氢氧化钠 | D. | 含0.1mol NaOH |
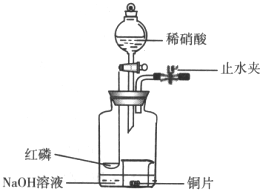 用如图示装置制备NO并验证其还原性.
用如图示装置制备NO并验证其还原性.