题目内容
15.常温下,下列各组离子一定能大量共存的是( )| A. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | [H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | [OH-]/[H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、[Al(OH)4]-、HCO3- |
分析 A.滴加甲基橙试剂显红色的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化亚铁离子;
B.[H+]=10-12 mol•L-1的溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.[OH-]/[H+]=1012的溶液中存在大量氢氧根离子,铵根离子、铝离子与氢氧根离子反应,碳酸根离子与铝离子发生双水解反应;
D.由水电离的[H+]=1.0×10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,偏铝酸根离子、碳酸氢根离子与氢离子反应,铝离子、碳酸氢根离子与氢氧根离子反应.
解答 解:A.滴加甲基橙试剂显红色的溶液为酸性溶液,Fe2+、NO3-在酸性溶液中发生氧化还原反应,不能大量共存,故A错误;
B.[H+]=10-12 mol•L-1的溶液中存在大量氢氧根离子,K+、Ba2+、Cl-、Br-之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.[OH-]/[H+]=1012的溶液为碱性溶液,溶液中存在大量氢氧根离子,NH4+、Al3+与氢氧根离子反应,Al3+、CO32-之间发生双水解反应,在溶液中不能大量共存,故C错误;
D.由水电离的[H+]=1.0×10-13 mol•L-1的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,[Al(OH)4]-、HCO3-与氢离子反应,NH4+、HCO3-与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.

 口算题天天练系列答案
口算题天天练系列答案| A. | Z-+H2O═HZ+OH- | B. | HY+H2O═H3O++Y- | ||
| C. | 常温下,电离度:HX>HY>HZ | D. | HX+Z-→X-+HZ |
| A. | 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| B. | 除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤 | |
| C. | 除去FeC13 酸性溶液中少量的FeC12:加入稍过量双氧水后放置 | |
| D. | 除去蛋白质溶液中混入的少量氯化钠:加AgNO3溶液后过滤 |
| A. | X=Y+0.01 | B. | X=2Y | C. | Y=2X | D. | X=Y+0.02 |
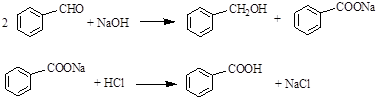
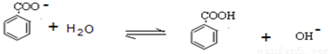 .
.
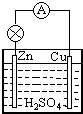 原电池是直接把化学能转化为电能的装置.如图所示:
原电池是直接把化学能转化为电能的装置.如图所示: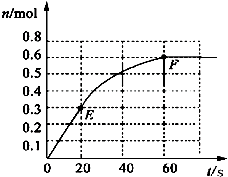 373K时,某1L密闭容器中加入1mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
373K时,某1L密闭容器中加入1mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.