题目内容
16.纯碱是一种重要的化工原料.目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺.请按要求回答问题:(1)写出“联合制碱法”有关反应的化学方程式:NH3+H2O+CO2+NaCl(饱和)═NaHCO3↓+NH4Cl;2NaHCO3$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)CO2是制碱工业的重要原料,“联合制碱法”中CO2来源于合成氨厂,“氨碱法”中CO2来源于煅烧石灰石.
分析 (1)联合制碱法的原理为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl、2NaHCO3$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)联合制碱法中CO2来源于石灰石煅烧,氨碱法中CO2的来源于合成氨工业的废气.
解答 解:(1)联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法的原理为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl、2NaHCO3$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO2↑+H2O;
故答案为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl、2NaHCO3$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)氨碱法中CO2的来源于合成氨工业的废气,联合制碱法中CO2来源于石灰石煅烧;
故答案为:合成氨厂;煅烧石灰石.
点评 本题考查了“联合制碱法”的原理,掌握反应的原理是解题的关键,题目难度不大,侧重考查学生对基础知识的掌握.

练习册系列答案
相关题目
6.铜锌原电池(如图)工作时,下列叙述正确的是( )
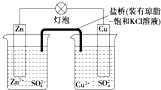

| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 盐桥中的K+移向ZnSO4溶液 | ||
| C. | 在外电路中,电流从负极流向正极 | D. | 电池反应为:Zn+Cu2+═Zn2++Cu |
1.下列有关原子轨道的能量和电子运动状态的说法正确的是( )
| A. | 同一原子中,形状相同的原子轨道(即能级)的能量相同 | |
| B. | 同一原子中的2p能级上 的电子的运动状态完全相同 | |
| C. | 多电子原子中,核外电子的运动遵循能量最低原理 | |
| D. | 多电子原子中,每个能层(即电子层)上电子的能量一定不同 |
5.下列有机物的转化中没有进行的反应类型是( )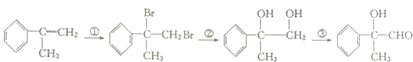

| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 氧化反应 |
6.下列关于离子化合物和共价化合物的叙述中正确的是( )
| A. | 离子化合物一定只含离子键 | |
| B. | 共价化合物可能含有离子键 | |
| C. | 只含离子键的纯净物一定是离子化合物 | |
| D. | 只含共价键的纯净物一定是共价化合物 |
 下表是元素周期表的一部分,表中每一序号分别代表一种元素.
下表是元素周期表的一部分,表中每一序号分别代表一种元素.