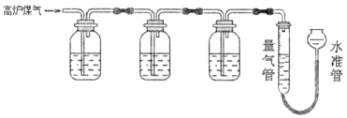
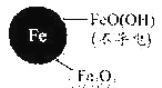题目内容
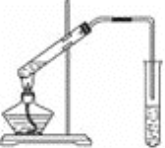
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究,将质量相同的粉末状和块状的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据。
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:______。该反应是______(填“放热”或“吸热”)反应。
(2)实验结果表明,催化剂的催化效果与____有关。
(3)某同学在10 mLH2O2溶液中加入一定量的MnO2,放出气体的体积(标准状况)与反应时间的关系如下图所示,则A、B、C三点所表示的反应速率最慢的是____。

Ⅱ.某反应在体积为5 L的恒容密闭容器中进行,在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体)。

(4)该反应的化学方程式为____。
(5)反应开始至2分钟时,B的平均反应速率为_____,A的转化率为______。
【答案】2H2O2![]() 2H2O +O2↑ 放热 催化剂接触面积的大小 C 2A+B
2H2O +O2↑ 放热 催化剂接触面积的大小 C 2A+B![]() 2C 0.1 mol/(L·min) 40%
2C 0.1 mol/(L·min) 40%
【解析】
Ⅰ.(1)二氧化锰是过氧化氢分解的催化剂,由带火星木条复燃,可知产物,由此可写出方程式,反应发生后溶液温度升高,说明反应为放热反应;
(2)由实验现象可知催化剂作用大小的影响因素;
(3)A、B、C三点的斜率代表反应速率,斜率越大,反应速率越大;
Ⅱ.(4)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(5)化学反应速率是单位时间内浓度的变化,据此可求得反应速率;利用转化率等于转化量与起始量的比值计算物质的平衡转化率。
I.(1)上述实验中发生反应的化学方程式为:2H2O2![]() 2H2O +O2↑,反应发生后物质温度升高,说明H2O2的分解反应为放热反应;
2H2O +O2↑,反应发生后物质温度升高,说明H2O2的分解反应为放热反应;
(2)反应时间少,则反应速率快,实验结果表明,催化剂的催化效果与催化剂的表面积有关;
(3)由图可知,曲线斜率变小,反应速率减小,则A、B、C三点所表示的反应速率最慢的是C;
Ⅱ.(4)由图象可知:A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,则C为生成物,当反应到达2 min时,△n(A)=2 mol,△n(B)=1 mol,△n(C)=2 mol,在化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,2 min后外界条件不变,三种物质都存在,且各种物质的物质的量都不发生变化,说明该反应为可逆反应,故反应的化学方程式为:2A+B![]() 2C;
2C;
(5)由图象可以看出,反应开始至2分钟时,△n(B)=1 mol,B的平均反应速率v(B)=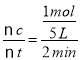 =0.1 mol/(L·min);2 min内A改变的物质的量为△n(A)=2 mol,反应开始时A物质的量是5 mol,所以A的反应转化率为
=0.1 mol/(L·min);2 min内A改变的物质的量为△n(A)=2 mol,反应开始时A物质的量是5 mol,所以A的反应转化率为![]() ×100%=40%。
×100%=40%。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
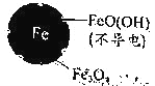
(1)Fe还原水体中NO3-的反应原理如图所示。
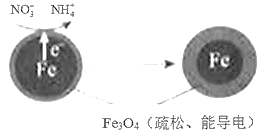
①作负极的物质是____。
②正极的电极反应式是____。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是____。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:____。
【题目】国庆70周年阅兵式展示了我国研制的各种导弹。导弹之所以有神奇的命中率,与材料息息相关,镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物(如砷化镓、磷化镓等)都是常用的半导体材料。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]__。
(2)根据元素周期律,原子半径Ga__As,第一电离能Ga__As。(填“大于”或“小于”)
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是__。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因:__。
晶体 | GaN | GaP | GaAs |
熔点/℃ | 1700 | 1480 | 1238 |
(5)GaN晶胞的结构如图1所示。已知六棱柱底边边长为acm,阿伏加德罗常数的值为NA。
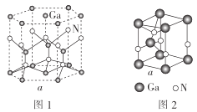
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为__。
②从GaN晶体中“分割”出的平行六面体如图2。若该平行六面体的体积为![]() a3cm3,则GaN晶体的密度为__(用含a、NA的代数式表示)g·cm-3。
a3cm3,则GaN晶体的密度为__(用含a、NA的代数式表示)g·cm-3。