题目内容
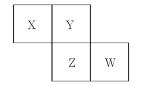
【题目】实验室用下图所示的装置制取乙酸乙酯

(1)在大试管中加入碎瓷片然后配制一定比例的乙醇、乙酸和浓硫酸的混合液,然后轻轻振荡试管使之混合均匀,加入碎瓷片的目的的________。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是____________。
(3)图中右边试管中试剂是_________________。作用是①__________________②_______________________________③____________________________。
(4)分离得到乙酸乙酯的方法是____________,分离需要的玻璃仪器是______________________。
(5)写出制乙酸乙酯的方程式____________________________________。
【答案】防止暴沸 防止倒吸 饱和碳酸钠溶液 溶解乙醇 中和乙酸 降低乙酸乙酯的溶解度,便于分层析出 分液 分液漏斗、烧杯 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
【解析】
此题是对乙酸乙酯制备的基础考查,根据反应原理即可作答,饱和碳酸钠的作用有三条,要考虑左边试管加热,挥发出来的乙醇和乙酸对于收集乙酸乙酯纯度的干扰,从而确定其作用。
(1)加热混合液体时,为防止暴沸,通常加入沸石或碎瓷片,故加入碎瓷片的目的是防止暴沸;
(2)由于挥发出的乙醇和乙酸易溶于水,溶于水后导管内压强减小,从而引起倒吸,故通蒸气的导管不能插入溶液中,目的是防止倒吸;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,故右边试管中试剂是饱和碳酸钠溶液,其主要作用为吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度、便于分层,然后分液即可分离,故答案为:溶解乙醇、中和乙酸、降低乙酸乙酯的溶解度,便于分层析出;
(4)乙酸乙酯不溶于水,加饱和碳酸钠溶液振荡、静置后,与乙酸乙酯分层,则要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,分液需要的玻璃仪器是分液漏斗和烧杯;
(5)制乙酸乙酯的方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。

【题目】二甲醚是一种重要的清洁燃料,可替代氟氯代烷作制冷剂,利用水煤气合成二甲醚的三步反应如下:
2H2(g)+CO(g)=CH3OH(g) ΔH=-90.8 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
请回答下列问题。
(1)由 H2和CO直接制备二甲醚的总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的ΔH=________。一定条件下的密闭容器中,该总反应达到平衡,要提高CO的平衡转化率,可以采取的措施有________(填字母代号)。
a.高温高压 b.加入催化剂 c.分离出CO2
d.增加CO的量 e.分离出二甲醚
(2)某温度下反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正___(填“>”“<”或“=”)v逆。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________,该时间段内v(CH3OH)=________。
(3)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0 MPa的条件下,在相同时间内测得CH3OCH3产率随温度变化的曲线如图甲所示。其中CH3OCH3产率随温度升高而降低的原因可能是_____________________________________。

(4)二甲醚直接燃料电池具有启动快、效率高、能量密度高等优点,可用于电化学降解治理水中硝酸盐的污染。电化学降解NO3-的原理如图乙所示。若电解质为酸性,二甲醚直接燃料电池的负极反应式为____________________;若电解过程中转移了2 mol电子,则阳极室减少的质量为_________g。
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究,将质量相同的粉末状和块状的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据。
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:______。该反应是______(填“放热”或“吸热”)反应。
(2)实验结果表明,催化剂的催化效果与____有关。
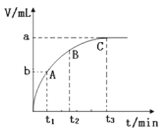
(3)某同学在10 mLH2O2溶液中加入一定量的MnO2,放出气体的体积(标准状况)与反应时间的关系如下图所示,则A、B、C三点所表示的反应速率最慢的是____。
Ⅱ.某反应在体积为5 L的恒容密闭容器中进行,在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体)。
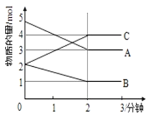
(4)该反应的化学方程式为____。
(5)反应开始至2分钟时,B的平均反应速率为_____,A的转化率为______。