题目内容
【题目】某同学在家期间设计了如下实验验证家中常见的两种有机物性质,请根据题目要求填写下列空格:
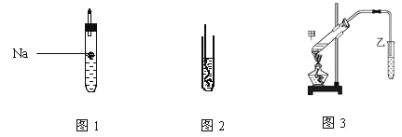
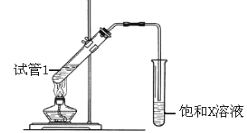
(1)如图1所示,试管中装乙醇产生反应的方程式_____ ,该反应类型为____ ;
(2)如图2所示,螺旋状的铜丝加热后可以铜丝表面变成______色,插入到装有乙醇的试管中铜丝表面又变成___色,并闻到有刺激性气味,该物质的结构简式为__;
(3)将鸡蛋放入食醋中看到鸡蛋表面有气泡生成,说明醋酸的酸性_____碳酸的酸性。(填“强于”或“弱于”)
(4)按如图3所示装置,甲试管中装有乙酸、乙醇、浓硫酸还需要加入____,目的是_______;加热时发生的反应方程式为__________,一段时间后在装有饱和碳酸钠溶液的乙试管______(填“上方”或“下方”)可以看到油状物质并闻到有特殊香味,分离该物质的实验操作是_______。
【答案】2CH3CH2OH+2Na2CH3CH2ONa+H2↑ 置换反应 黑 红 CH3CHO 强于 碎瓷片 防止爆沸 CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O 上方 分液
CH3COOC2H5+H2O 上方 分液
【解析】
(1)试管中钠与乙醇反应生成氢气与乙醇钠;
(2)螺旋状的铜丝加热后被空气中的氧气氧化生成氧化铜,再插入到装有乙醇的试管中,乙醇将铜丝表面的氧化铜还原为铜单质,发生反应为:C2H5OH+CuO![]() CH3CHO+Cu+H2O;
CH3CHO+Cu+H2O;
(3)鸡蛋壳的主要成分为碳酸钙,将鸡蛋放入食醋中看到鸡蛋表面有气泡生成,发生反应为:2CH3COOH+CaCO3= (CH3COO)2Ca+CO2↑+H2O;
(4)乙酸和乙醇在浓硫酸作催化剂、加热条件下发生反应生成乙酸乙酯,饱和碳酸钠溶液吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,且乙酸乙酯的密度比水密度小,不溶于水,分层后有机层在上层据此分析解答。
(1)如图1所示,试管中钠与乙醇反应生成氢气与乙醇钠,化学反应方程式2CH3CH2OH+2Na2CH3CH2ONa+H2↑,该反应类型为置换反应;
(2)如图2所示,螺旋状的铜丝加热后被空气中的氧气氧化生成氧化铜,铜丝表面变成黑色,插入到装有乙醇的试管中,被氧化的铜丝与乙醇发生氧化还原反应,乙醇将铜丝表面的氧化铜还原为铜单质,发生反应为:C2H5OH+CuO![]() CH3CHO+Cu+H2O,铜丝表面又变成红色,并闻到有刺激性气味,该物质为乙醛,其结构简式为CH3CHO;
CH3CHO+Cu+H2O,铜丝表面又变成红色,并闻到有刺激性气味,该物质为乙醛,其结构简式为CH3CHO;
(3)鸡蛋壳的主要成分为碳酸钙,将鸡蛋放入食醋中看到鸡蛋表面有气泡生成,发生反应为:2CH3COOH+CaCO3= (CH3COO)2Ca+CO2↑+H2O,根据反应符合强酸制取弱酸,说明醋酸的酸性强于碳酸的酸性;
(4)按如图3所示装置,甲试管中装有乙酸、乙醇、浓硫酸还需要加入碎瓷片,目的是防止液体爆沸;加热时发生的反应方程式为CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O,乙酸乙酯的密度比水小,且不溶于水,一段时间后在装有饱和碳酸钠溶液的乙试管上方可以看到油状物质并闻到有特殊香味,分离互不相互两种液体的实验操作是分液。
CH3COOC2H5+H2O,乙酸乙酯的密度比水小,且不溶于水,一段时间后在装有饱和碳酸钠溶液的乙试管上方可以看到油状物质并闻到有特殊香味,分离互不相互两种液体的实验操作是分液。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究,将质量相同的粉末状和块状的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据。
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:______。该反应是______(填“放热”或“吸热”)反应。
(2)实验结果表明,催化剂的催化效果与____有关。
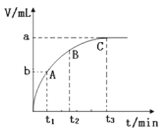
(3)某同学在10 mLH2O2溶液中加入一定量的MnO2,放出气体的体积(标准状况)与反应时间的关系如下图所示,则A、B、C三点所表示的反应速率最慢的是____。
Ⅱ.某反应在体积为5 L的恒容密闭容器中进行,在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体)。
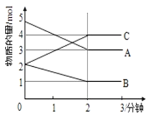
(4)该反应的化学方程式为____。
(5)反应开始至2分钟时,B的平均反应速率为_____,A的转化率为______。