题目内容
【题目】国庆70周年阅兵式展示了我国研制的各种导弹。导弹之所以有神奇的命中率,与材料息息相关,镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物(如砷化镓、磷化镓等)都是常用的半导体材料。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]__。
(2)根据元素周期律,原子半径Ga__As,第一电离能Ga__As。(填“大于”或“小于”)
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是__。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因:__。
晶体 | GaN | GaP | GaAs |
熔点/℃ | 1700 | 1480 | 1238 |
(5)GaN晶胞的结构如图1所示。已知六棱柱底边边长为acm,阿伏加德罗常数的值为NA。
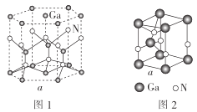
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为__。
②从GaN晶体中“分割”出的平行六面体如图2。若该平行六面体的体积为![]() a3cm3,则GaN晶体的密度为__(用含a、NA的代数式表示)g·cm-3。
a3cm3,则GaN晶体的密度为__(用含a、NA的代数式表示)g·cm-3。
【答案】3d104s24p4 大于 小于 4 原子半径N<P<As,键长Ga—N<Ga—P<Ga—As,键能Ga—N>Ga—P>Ga—As,故CaN、GaP、GaAs的熔点逐渐降低 12 ![]()
【解析】
(1)基态硒原子序数为34,根据构造原理写出其核外电子排布式;
(2)同一周期中从左到右,原子半径逐渐减小,同一周期从左到右,元素的第一电离能有增大趋势,但IIA、VA族第一电离能大于同周期相邻元素;
(3)二氧化硅晶体中含有“SiO4”结构单元,1个Si原子结合4个O原子,同时每个O原子结合2个Si原子;
(4)原子晶体中,原子半径越大,共价键键长越长,共价键越弱,键能越小,晶体的熔点越低;
(5)①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为12;
②均摊法计算晶胞(平行六面体)中Ga、N原子数目,计算原子总质量,根据晶体密度=晶胞质量÷晶胞体积。
(1)Se是34号元素,位于第四周期ⅥA族,核外电子排布式为[Ar]3d104s24p4;
(2)根据元素周期律,Ga与As位于同一周期,Ga原子序数小于As,故原子半径Ga大于As,同周期第一电离能变化趋势是从左到右增大,故第一电离能Ga小于As;
(3)水晶中1个硅原子结合4个氧原子,同时每个氧原子结合2个硅原子,所以水晶是以[SiO4]四面体向空间延伸的立体网状结构,水晶中硅原子的配位数为4;
(4)原子半径N<P<As,键长Ga—N<Ga—P<Ga—As,键能Ga—N>Ga—P>Ga—As,故GaN、GaP、GaAs的熔点逐渐降低;
(5)从六方晶胞的面心原子分析,上、中、下层分别有3、6、3个配位原子,故配位数为12。六方晶胞中原子的数目往往采用均摊法:①位于晶胞顶点的原子为6个晶胞共用,对一个晶胞的贡献为![]() ;②位于晶胞面心的原子为2个晶胞共用,对一个晶胞的贡献为
;②位于晶胞面心的原子为2个晶胞共用,对一个晶胞的贡献为![]() ;③位于晶胞侧棱的原子为3个晶胞共用,对一个晶胞的贡献为
;③位于晶胞侧棱的原子为3个晶胞共用,对一个晶胞的贡献为![]() ;④位于晶胞体心的原子为1个晶胞共用,对一个晶胞的贡献为1。GaN晶胞中Ga原子个数为
;④位于晶胞体心的原子为1个晶胞共用,对一个晶胞的贡献为1。GaN晶胞中Ga原子个数为![]() ,N原子个数为
,N原子个数为![]() ,所以该晶胞化学式为Ga6N6,质量为
,所以该晶胞化学式为Ga6N6,质量为![]() g,该六棱柱的底面为正六边形,边长为acm,底面的面积为6个边长为acm的正三角形面积之和,根据正三角形面积的计算公式,该底面的面积为
g,该六棱柱的底面为正六边形,边长为acm,底面的面积为6个边长为acm的正三角形面积之和,根据正三角形面积的计算公式,该底面的面积为![]() ,由图2可知六棱柱的高为
,由图2可知六棱柱的高为![]() ,所以晶胞的体积为
,所以晶胞的体积为![]() ,密度为
,密度为 gcm3。
gcm3。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究,将质量相同的粉末状和块状的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据。
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:______。该反应是______(填“放热”或“吸热”)反应。
(2)实验结果表明,催化剂的催化效果与____有关。
(3)某同学在10 mLH2O2溶液中加入一定量的MnO2,放出气体的体积(标准状况)与反应时间的关系如下图所示,则A、B、C三点所表示的反应速率最慢的是____。

Ⅱ.某反应在体积为5 L的恒容密闭容器中进行,在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体)。

(4)该反应的化学方程式为____。
(5)反应开始至2分钟时,B的平均反应速率为_____,A的转化率为______。
【题目】氯化亚硝酰(NOCl,沸点为-5.5℃)是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2+HNO3=AgNO3+HNO2。
(1)将5g在300℃下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002molNO2。反应12~36min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为_。氯化钾需要“干燥”的原因是__。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为__。
②干燥管中盛放的试剂为_。
③生成NOCl的化学方程式为__。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5mL仪器a中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O反应的化学方程式为__ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为__ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为_ |




