题目内容
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中制取高纯碳酸钴(CoCO3)的工艺流程如图:
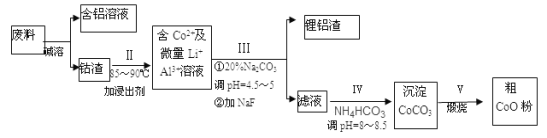
(1)写出一条加快碱溶速率的措施__。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程式为__(产物中只有一种酸根)。该过程不能用盐酸代替硫酸进行酸化,原因是_。
(3)过程Ⅲ中碳酸钠溶液的作用是沉淀Al3+和Li+,写出沉淀Al3+的离子方程式__。
(4)过程Ⅳ沉钴的离子方程式是__。
(5)CoCO3可用于制备锂离子电池的正极材料LiCoO2,其生产工艺是将n(Li):n(Co)=l:l的Li2CO3和CoCO3的固体混合物在空气中加热至700℃~900℃。试写出该反应的化学方程式__。
【答案】废料粉碎、升高温度、增大碱液的浓度。 4Co2O3·CoO + S2O32-+ 22H+= 12Co2++ 2SO42-+ 11H2O Co2O3·CoO可氧化盐酸产生Cl2,污染环境 2Al3++3CO32-+3H2O = 2Al(OH)3↓+3CO2↑ Co2++2HCO3-= CoCO3↓+CO2↑+H2O 2Li2CO3+4CoCO3+O2![]() 4LiCoO2+ 6CO2↑
4LiCoO2+ 6CO2↑
【解析】
(1)根据影响反应速率的因素回答加快碱溶速率的措施;
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液,Co3+被还原为Co2+, S2O32-被氧化为SO42-;Co3+具有强氧化性,能把盐酸氧化为氯气;
(3)过程Ⅲ中碳酸根离子与Al3+发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
(4)过程Ⅳ沉钴是Co2+与HCO3-反应生成CoCO3沉淀和二氧化碳气体;
(5)将n(Li):n(Co)=l:l的Li2CO3和CoCO3的固体混合物在空气中加热至700℃~900℃生成LiCoO2,氧气把Co(Ⅱ)氧化为Co(Ⅲ),根据电子守恒配平方程式。
(1)根据影响反应速率的因素,废料粉碎、升高温度、增大碱液的浓度都可以加快碱溶速率;
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液,Co(Ⅲ)被还原为Co(Ⅱ), S2O32-被氧化为SO42-,浸出钴的离子反应方程式为4Co2O3·CoO + S2O3 2-+ 22H+= 12Co2++ 2SO42- + 11H2O。Co2O3·CoO具有强氧化性,能把盐酸氧化为Cl2,污染环境,所以不能用盐酸代替硫酸进行酸化;
(3)过程Ⅲ中碳酸根离子与Al3+发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,沉淀Al3+的离子方程式是2Al3++3CO32-+3H2O = 2Al(OH)3↓+3CO2↑;
(4)过程Ⅳ沉钴是Co2+与HCO3-反应生成CoCO3沉淀和二氧化碳气体,反应的离子方程式是Co2++2HCO3-= CoCO3↓+CO2↑+H2O;
(5)将n(Li):n(Co)=l:l的Li2CO3和CoCO3的固体混合物在空气中加热至700℃~900℃生成LiCoO2,氧气把Co(Ⅱ)氧化为Co(Ⅲ),根据电子守恒配平方程式为2Li2CO3+4CoCO3+O2![]() 4LiCoO2+ 6CO2↑。
4LiCoO2+ 6CO2↑。

【题目】二甲醚是一种重要的清洁燃料,可替代氟氯代烷作制冷剂,利用水煤气合成二甲醚的三步反应如下:
2H2(g)+CO(g)=CH3OH(g) ΔH=-90.8 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
请回答下列问题。
(1)由 H2和CO直接制备二甲醚的总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的ΔH=________。一定条件下的密闭容器中,该总反应达到平衡,要提高CO的平衡转化率,可以采取的措施有________(填字母代号)。
a.高温高压 b.加入催化剂 c.分离出CO2
d.增加CO的量 e.分离出二甲醚
(2)某温度下反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正___(填“>”“<”或“=”)v逆。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________,该时间段内v(CH3OH)=________。
(3)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0 MPa的条件下,在相同时间内测得CH3OCH3产率随温度变化的曲线如图甲所示。其中CH3OCH3产率随温度升高而降低的原因可能是_____________________________________。

(4)二甲醚直接燃料电池具有启动快、效率高、能量密度高等优点,可用于电化学降解治理水中硝酸盐的污染。电化学降解NO3-的原理如图乙所示。若电解质为酸性,二甲醚直接燃料电池的负极反应式为____________________;若电解过程中转移了2 mol电子,则阳极室减少的质量为_________g。
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究,将质量相同的粉末状和块状的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据。
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:______。该反应是______(填“放热”或“吸热”)反应。
(2)实验结果表明,催化剂的催化效果与____有关。
(3)某同学在10 mLH2O2溶液中加入一定量的MnO2,放出气体的体积(标准状况)与反应时间的关系如下图所示,则A、B、C三点所表示的反应速率最慢的是____。

Ⅱ.某反应在体积为5 L的恒容密闭容器中进行,在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体)。

(4)该反应的化学方程式为____。
(5)反应开始至2分钟时,B的平均反应速率为_____,A的转化率为______。
【题目】氯化亚硝酰(NOCl,沸点为-5.5℃)是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2+HNO3=AgNO3+HNO2。
(1)将5g在300℃下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002molNO2。反应12~36min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为_。氯化钾需要“干燥”的原因是__。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为__。
②干燥管中盛放的试剂为_。
③生成NOCl的化学方程式为__。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5mL仪器a中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O反应的化学方程式为__ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为__ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为_ |






