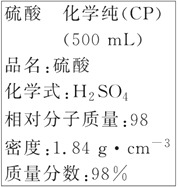
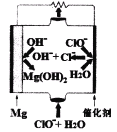
题目内容
【题目】下表是元素周期表前四周期部分,针对表中的①~⑨9种元素,用化学用语填写下列空白:
① | ② | ③ | |||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | |||||||||||||||||
(1)①~⑨中,单质化学性质最不活泼的是__________,最高价氧化物对应的水化物的酸性最强的是__________。
(2)②、③、④的简单离子按离子半径从小到大排列顺序为_________________。
(3)④在③单质中燃烧的产物的电子式为_________________。
(4)⑤的原子结构示意图为________,从原子结构分析,④比⑤活泼的原因是_________。
(5)②和⑦形成一种化合物分子,各原子均达到8电子稳定结构,则该化合物的化学式为_________________。
(6)②、③的最简单氢化物中,沸点较高的是_____________。
(7)②的简单氢化物与②的最高价氧化物的水化物溶液反应的化学方程式为:________。
【答案】Ar HClO4 Na+ < O2— < N3— 
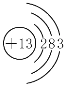 钠原子半径大于铝,最外层电子数比铝少,最外层电子比较容易失去 NCl3 H2O NH3 + HNO3 = NH4NO3
钠原子半径大于铝,最外层电子数比铝少,最外层电子比较容易失去 NCl3 H2O NH3 + HNO3 = NH4NO3
【解析】
根据元素在周期表中位置分析元素的种类,根据元素性质及元素周期律分析解答。
(1)单质性质最不活泼的应该是0族元素形成的单质,单质化学性质最不活泼的是⑧号的Ar;最高价氧化物对应的水化物的酸性最强,则非金属性最强,元素周期表中,越往上越往后非金属性越强,所以非金属性最强的是⑦号Cl,其最高价氧化物对应的水化物是HClO4,故答案为:Ar ; HClO4;
(2)根据元素在周期表的位置分析,②、③、④分别为N、O、Na,它们的简单离子具有相同的核外电子排布,核电荷越大,离子半径越小,所以按离子半径从小到大排列顺序为:Na+ < O2- < N3-,故答案为:Na+ < O2- < N3-;
(3)④是钠,③是氧,钠在氧气中燃烧生成过氧化钠,过氧化钠为离子化合物,其电子式为 ,故答案为:
,故答案为: ;
;
(4)⑤是铝,原子核外电子数为13,则Al的原子结构示意图为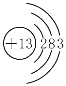 ;从原子结构分析,同周期元素核电荷越大,半径越小,所以④比⑤半径大,失电子能力强,故活泼性强,故答案为:
;从原子结构分析,同周期元素核电荷越大,半径越小,所以④比⑤半径大,失电子能力强,故活泼性强,故答案为: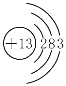 ;钠原子半径大于铝,最外层电子数比铝少,最外层电子比较容易失去;
;钠原子半径大于铝,最外层电子数比铝少,最外层电子比较容易失去;
(5)②为N,最外层有5个电子,⑦为Cl,最外层有7个电子,为了到达8电子稳定结构,则1个N原子与3个Cl原子形成3对共用电子对,则形成一种化合物分子的化学式为:NCl3,故答案为:NCl3;
(6)②、③的最简单氢化物分别为NH3和H2O,,NH3通常状态下为气态,H2O通常状态下为液态,所以沸点较高的是H2O,故答案为:H2O;
(7)②的简单氢化物为NH3,②的最高价氧化物的水化物为HNO3,反应生成硝酸铵,化学方程式为NH3 + HNO3 =NH4NO3,故答案为:NH3 + HNO3 =NH4NO3。