题目内容
【题目】镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(S) △H1=- 74.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=- 64.4kJ·mol-l
则:Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)的△H3=__________.
(2)某科研小组用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

科研小组将MgCl2·6H2O在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。
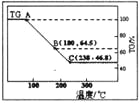
①图中AB线段为“一段脱水”,试确定B点对应固体物质的化学式_________________;图中BC线段为“二段脱水”,在实验中通入H2和Cl2燃烧产物的目的是_______________。
②该工艺中,可以循环使用的物质有_____________。
(3)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是________________,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式__________________。
(4)储氢材料Mg(AIH4)2在110~200℃的反应为:Mg(AIH4)2=MgH2+2Al+3H2↑;每转移3 mol电子生成Al的质量为_______________。
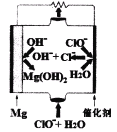
(5)“镁一次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为_______________。
【答案】+84.6kJ/mol MgCl2·2H2O 为防止MgCl2·2H2O脱水过程中发生水解反应 HCl、 Cl2 +2 2CH3MgCl +2H2O→Mg(OH)2+MgCl2+2CH4↑ 27g ClO-+2e-+H2O=Cl-+2OH-
【解析】
(1)已知:①Mg(s)+H2(g)=MgH2(S) △H1=—74.5kJ·mol-1,②Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=—64.4kJ·mol-l,则根据盖斯定律可知②—①×2即可得到Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)的△H3=+84.6kJ/mol。
(2)①设原样品是1mol,质量是203g,B点剩余固体的质量是203g×0.646=131g,即固体减少了72g,恰好是4mol水的质量,所以此时固体的化学式为MgCl2·2H2O。由于镁氯化水解生成氢氧化镁和氯化氢,加热能促进镁离子水解,所以为防止MgCl2·2H2O脱水过程中发生水解反应,需要在实验中通入H2和Cl2燃烧产物氯化氢。
②二段脱水时产生氯化氢,以及电解时生成的氯气均可以循环使用。
(3)CH3MgCl是一种重要的有机合成剂,其中C、H、Cl的化合价分别是—4价、+1价和—1价,所以根据化合物中化合价代数和为0可知镁的化合价是+2价。该化合物水解时生成甲烷、氯化镁和氢氧化镁,因此该反应的化学方程式为2CH3MgCl +2H2O→Mg(OH)2+MgCl2+2CH4↑。
(4)根据方程式Mg(AIH4)2=MgH2+2Al+3H2↑可知铝元素的化合价从+3价降低到0价,失去3个电子,则每转移3 mol电子生成1molAl,其质量为27g。
(5)原电池中正极得到电子,发生还原反应,则根据装置图可知负极镁失去电子,正极次氯酸根得到电子,因此该电池的正极反应式为ClO-+2e-+H2O=Cl-+2OH-。

【题目】(1)Ⅰ.太阳能、风能发电逐渐得到广泛应用,在发电系统中安装储能装置有助于持续稳定供电,其构造的简化图如下

下列说法中,不正确的是________ (填字母序号)
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(2)全钒液流电池是具有发展前景的、用作储能系统的蓄电池。已知放电时V2+发生氧化反应,则放电时电极A的电极反应式为________ 。
(3)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+, Fe3+)等进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液pH范围不同时,钒的存在形式如下表所示
钒的化合价 | pH<2 | pH>11 |
+4价 | VO2+, VO(OH)+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①加入NaOH调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH后涉及到氧化物还原反应的化学反应方程式为________。
②向碱性的滤液1(V的化合价为+4)中加入H2O2的作用是________ 。
(4)Ⅱ.氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
![]()
Ⅰ中加入NaOH溶液,调pH=11并鼓入大量空气,用离子方程式表示加NaOH溶液的作用是________;鼓入大量空气的目的是________。
(5)Ⅱ中加入适量NaClO溶液,控制pH在6~7,将氨氮转化为无毒物质,过程Ⅱ发生3个反应:
ⅰ.ClO-+H+=HClO
ⅱ.NH4++HClO=NH2Cl+H++H2O(NH2Cl中Cl元素为+1价)
ⅲ. ……
已知:水体中以+1价形式存在的氯元素有消毒杀菌的作用,被称为“余氯”。下图为NaClO加入量与“余氯”含量的关系示意图。其中氨氮含量最低的点是c点。

b点表示的溶液中氮元素的主要存在形式是(用化学式表示) ________;反应ⅲ的化学方程式是________。
(6)Ⅲ中用Na2SO3溶液处理含余氯废水,要求达标废水中剩余Na2SO3的含量小于5mg·L-1。若含余氯废水中NaClO的含量是7.45mg·L-1,则处理10m3含余氯废水,至多添加10%Na2SO3溶液________kg(溶液体积变化忽略不计)。
【题目】下表是元素周期表前四周期部分,针对表中的①~⑨9种元素,用化学用语填写下列空白:
① | ② | ③ | |||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | |||||||||||||||||
(1)①~⑨中,单质化学性质最不活泼的是__________,最高价氧化物对应的水化物的酸性最强的是__________。
(2)②、③、④的简单离子按离子半径从小到大排列顺序为_________________。
(3)④在③单质中燃烧的产物的电子式为_________________。
(4)⑤的原子结构示意图为________,从原子结构分析,④比⑤活泼的原因是_________。
(5)②和⑦形成一种化合物分子,各原子均达到8电子稳定结构,则该化合物的化学式为_________________。
(6)②、③的最简单氢化物中,沸点较高的是_____________。
(7)②的简单氢化物与②的最高价氧化物的水化物溶液反应的化学方程式为:________。