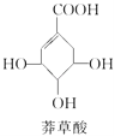
题目内容
【题目】已知酸性 ![]() >H2CO3>
>H2CO3>![]() >HCO3- ,综合考虑反应物的转化率和原料成本等因素,将
>HCO3- ,综合考虑反应物的转化率和原料成本等因素,将 转变
转变![]() 的方法有( )
的方法有( )
A.与稀 H2SO4 共热后,加入足量的 NaHCO3 溶液
B.与稀 H2SO4 共热后,加入足量的 Na2CO3 溶液
C.与足量的 NaOH 溶液共热后,再加入适量 H2SO4
D.与足量的 NaOH 溶液共热后,再通入足量 CO2
【答案】D
【解析】
根据酸性的强弱,可以强酸制弱酸,由此分析。
A.与稀硫酸反应后生成邻羟基苯甲酸,再加入NaHCO3溶液,羧基可与其反应生成目标产品,但是,由于酯在酸性条件下水解的程度较小,酯的转化率较小,故该方法中原料的转化较低,不符合题意,故A错误;
B.与稀硫酸反应后生成邻羟基苯甲酸,再加入碳酸钠溶液,酚羟基和羧基都反应,得不到目标产品,不符合,故B错误;
C.与足量NaOH溶液反应后,加入稀硫酸生成邻羟基苯甲酸,得不到目标产品,不符合,故C错误;
D.原料与足量NaOH溶液反应后,可以完全水解,原料的转化率很高;水解液中再通入足量二氧化碳,由于碳酸的酸性弱于苯甲酸、但强于苯酚,故可生成邻羟基苯甲酸钠,故D正确;
答案选D。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】下表是元素周期表前四周期部分,针对表中的①~⑨9种元素,用化学用语填写下列空白:
① | ② | ③ | |||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | |||||||||||||||||
(1)①~⑨中,单质化学性质最不活泼的是__________,最高价氧化物对应的水化物的酸性最强的是__________。
(2)②、③、④的简单离子按离子半径从小到大排列顺序为_________________。
(3)④在③单质中燃烧的产物的电子式为_________________。
(4)⑤的原子结构示意图为________,从原子结构分析,④比⑤活泼的原因是_________。
(5)②和⑦形成一种化合物分子,各原子均达到8电子稳定结构,则该化合物的化学式为_________________。
(6)②、③的最简单氢化物中,沸点较高的是_____________。
(7)②的简单氢化物与②的最高价氧化物的水化物溶液反应的化学方程式为:________。
【题目】在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=akJ·mol-1
CO(g)+H2O(g) ΔH=akJ·mol-1
其化学平衡常数K和温度T的关系如下表所示:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列有关叙述正确的是
A.a<0
B.可测量容器总压强变化来判定化学反应是否达到平衡
C.温度为830℃时,若c(CO2)·c(H2)>c(CO)·c(H2O),此时v正>v逆
D.温度不变,增大c(CO2),平衡右移,K增大