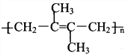
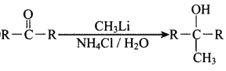题目内容
【题目】H2NNO2(硝酰胺,Nitrarnide)是一种弱酸,常温下Ka1=10-5.6。常温下,硝酰胺分解反应,H2NNO2(aq)=N2O(g)+H2O(l)的第-步为O2NNH2(aq)![]() O2NNH-(aq)+H+(aq),其中k为速率常数,υ正=k1c(O2NNH2),υ逆=k-1c(O2NNH-)·c(H+),则
O2NNH-(aq)+H+(aq),其中k为速率常数,υ正=k1c(O2NNH2),υ逆=k-1c(O2NNH-)·c(H+),则![]() 等于( )
等于( )
A.5.6B.8.4C.-5.6D.-8.4
【答案】C
【解析】
Ka1=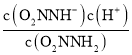 ,当反应达到平衡状态时,υ正=υ逆,据此进行计算。
,当反应达到平衡状态时,υ正=υ逆,据此进行计算。
Ka1=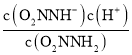 =10-5.6,当反应达到平衡状态时,υ正=υ逆,即k1c(O2NNH2)= k-1c(O2NNH-)·c(H+),那么
=10-5.6,当反应达到平衡状态时,υ正=υ逆,即k1c(O2NNH2)= k-1c(O2NNH-)·c(H+),那么![]() =
=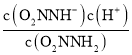 =10-5.6,因此
=10-5.6,因此![]() =lg(10-5.6)=-5.6;
=lg(10-5.6)=-5.6;
答案选C。

【题目】氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是_________________________________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________________________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
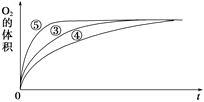
分析该图能够得出的实验结论是________________________________。
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。
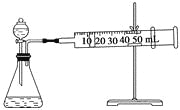
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_______或______来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:_____________。请计算H2O2的初始物质的量浓度为________________(保留两位有效数字)。
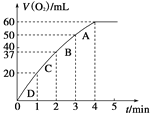
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):/span>a._________________;b.___________________。