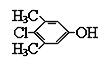
题目内容
【题目】氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是_________________________________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________________________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
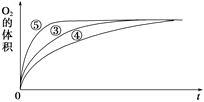
分析该图能够得出的实验结论是________________________________。
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。
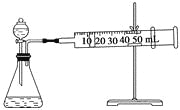
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_______或______来比较。
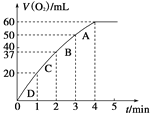
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:_____________。请计算H2O2的初始物质的量浓度为________________(保留两位有效数字)。
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):/span>a._________________;b.___________________。
【答案】探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中) 碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 相同时间内产生O2的体积 生成相同体积O2所需要的时间 随着反应的进行,浓度减小,反应速率减慢 0.11 mol·L-1 MnO2的质量有没有改变 MnO2的化学性质有没有改变
【解析】
I.(1)实验①和②中H2O2的浓度不同,其它条件相同,故实验目的是探究浓度对反应速率的影响;实验时没有观察到明显现象是因为反应太慢,那么就要采取措施加快反应,可以向反应物中加入等量同种催化剂或将盛有反应物的试管放入同一热水浴中。
(2)从图可以看出产生O2的最终体积相等,但溶液的酸碱性不同,反应速率不同,在碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。
II.(1)通过测定O2的体积来比较H2O2的分解速率快慢时可以看相同时间内产生O2的体积,或生成相同体积O2所需要的时间。
(2)从图可以看出,反应开始后,在相同的时间内生成的O2的体积逐渐减小,反应速率变慢,那么造成反应变慢的原因是随着反应的进行,浓度减小,反应速率减慢;反应在进行到4min时O2的体积不再改变,说明反应完全,生成O2的物质的量为:60×10-3L÷22.4L/mol=2.7×10-3mol,根据反应2H2O2=2H2O+O2↑,生成2.7×10-3mol O2,需要消耗H2O2的物质的量为5.4×10-3mol,则H2O2的物质的量浓度为:5.4×10-3mol÷ 0.05L=0.11 mol·L-1;要探究MnO2是不是起到催化作用,根据催化剂在反应中的特点:反应前后质量和性质没有发生改变,所以需要补做实验来确定MnO2的质量有没有改变、MnO2的化学性质有没有改变。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。