题目内容
【题目】研究电化学原理与应用有非常量要的意义。
(1)锌锰电池(俗称干电池)是一种一次电池,生活中应用广泛。若锌锰电池工作环境为酸性,则此时负极上的电极反应式为:___。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
①放电时正极反应为(离子方程式):___。
②铅蓄电池放电时,当消耗了10.35gPb时,转移的电子的物质的量为___。
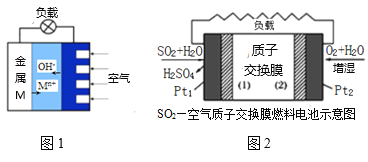
(3)如图1是金属(M)—空气电池的工作原理,我国首创的海洋电池以铅板为负极,铂网为正极,海水为电解质溶液,则该电池反应方程式为:___。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图2所示,则Pt2上的电极反应式为:___。
【答案】Zn-2e-=Zn2+ PbO2+2e-+SO42-+4H+=PbSO4+2H2O 0.01mol 4Al+3O2+6H2O=4Al(OH)3 O2+4H++4e-=2H2O
【解析】
(1)锌锰电池中活泼金属锌做负极,失去电子;
(2)①放电时负极Pb失电子发生氧化反应,负极反应式为Pb+SO42--2e-=PbSO4,由总反应式可推出正极方程式;
②10.35gPb的物质的量为![]() =0.05mol,Pb在反应中从0价变为+2价;
=0.05mol,Pb在反应中从0价变为+2价;
(3)根据已知条件,以铝做负极,有空气参与,生成OH-,故方程式为:4Al+3O2+6H2O=4Al(OH)3;燃料电池中Pt1做负极,Pt2做正极得电子,故电极方程式为:O2+4H++4e-=2H2O。
(1)锌锰电池中活泼金属锌做负极,失去电子,电极方程式为:Zn-2e-=Zn2+;
(2)①放电时负极Pb失电子发生氧化反应,负极反应式为Pb+SO42--2e-=PbSO4,由总反应式可知,该铅蓄电池中放电时,正极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O;
②10.35gPb的物质的量为![]() =0.05mol,Pb在反应中从0价变为+2价,消耗0.05molPb时转移0.05mol×2=0.01mol电子;
=0.05mol,Pb在反应中从0价变为+2价,消耗0.05molPb时转移0.05mol×2=0.01mol电子;
(3)根据已知条件,以铝做负极,有空气参与,生成OH-,故方程式为:4Al+3O2+6H2O=4Al(OH)3;燃料电池中Pt1做负极,Pt2做正极得电子,故电极方程式为:O2+4H++4e-=2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
【题目】实验室中有一未知浓度的稀盐酸,请完成下列填空:
(1)配制100mL 0.10mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)___→洗涤(并将洗涤液移入容量瓶)→___→____→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__________g氢氧化钠固体,所需仪器有:天平(带砝码、镊子)、_______、________。
(2)取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成后,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.64 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有__________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失