题目内容
4.按要求书写下列氧化还原反应方程式(1)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,试写出该反应的离子方程式:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(2)将适量的SO2通入Fe(NO3)3溶液中,溶液逐渐由棕黄色变为浅绿色,但又立即变为棕黄色,请写出该过程中的离子方程式:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+,3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
(3)将NCl3与NaClO2(亚氯酸钠)按物质的量之比1:6混合,在溶液中恰好反应生成ClO2,试写出该反应的离子方程式NCl3+6ClO2-+3H2O═6ClO2↑+NH3↑+3Cl-+3OH-.
分析 (1)二价铁离子具有强的还原性,能够被次氯酸根离子氧化生成三价铁离子;
(2)三价铁离子氧化性大于二氧化硫,二者发生氧化还原反应生成硫酸根离子和二价铁离子;二价铁离子与硝酸根离子在酸性环境下反应生成三价铁离子、一氧化氮和水;
(3)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气;
解答 解:(1)硫酸亚铁与次氯酸钠在酸性环境下发生氧化还原反应,离子方程式:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O,
故答案为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(2)将适量的SO2通入Fe(NO3)3溶液中,溶液逐渐由棕黄色变为浅绿色,离子方程式:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+,但又立即变为棕黄色,是因为二价铁离子被硝酸根离子氧化,离子方程式为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
故答案为:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+;3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(3)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,则该反应的离子方程式:NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑,
故答案为:NCl3+6ClO2-+3H2O═6ClO2↑+NH3↑+3Cl-+3OH-.
点评 本题考查了离子方程式的书写,明确发生反应的实质是解题关键,题目难度中等.

练习册系列答案
相关题目
14.在372K时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为 0.02mol•L-1.在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.下列说法正确的是( )
| A. | 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L-1•s-1 | |
| B. | 在2s时体系内压强为开始时的1.1倍 | |
| C. | 在平衡时体系内含有N2O40.25 mol | |
| D. | 平衡时,N2O4的转化率为40% |
19.下列反应属于加成反应的是( )
| A. | CH2=CH2+H-OH$\stackrel{催化剂}{→}$ CH3CH2OH | |
| B. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$ 2HCl | |
| C. | CH3CH2Br+KOH$→_{△}^{H_{2}O}$CH3CH2OH+KBr | |
| D. | CH3CH3+2Cl2 $\stackrel{光}{→}$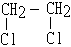 +2HCl +2HCl |
9.下列关于胶体的说法中不正确的是( )
| A. | 胶体外观不均一 | B. | 胶体能产生丁达尔效应 | ||
| C. | 胶体能透过滤纸 | D. | 胶体粒子直径在1-100 nm之间 |
13.下列关于气体和溶液的叙述正确的是( )
| A. | 0.5 mol•L-1 CuCl2溶液中含有3.01×1023个Cu2+ | |
| B. | 标准状况下,2.24 L CO2气体含有1.81×1023个氧原子 | |
| C. | 48 g O3气体含有6.02×1023个O3分子 | |
| D. | 标准状况下,33.6 L H2O含有1.5NA个H2O分子 |
14.已知外电路中,电子由铜流向a极.有关图中装置分析合理的一项是( )
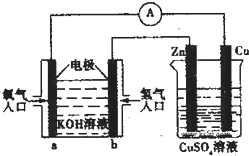

| A. | 一段时间后锌片质量减少 | |
| B. | 该装之中Cu极为正极 | |
| C. | b极的电极反应式:H2-2e-═2H+ | |
| D. | 当铜片的质量变化为12.8g时,a极上消耗的 O2在标况下的体积为2.24L |
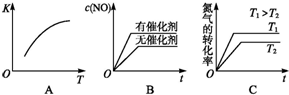 汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答:
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答: