题目内容
9.aL某浓度的SnC12溶液与过量FeC13溶液充分混合后,再加入$\frac{a}{2}$L 0.2000mol•L-1 K2Cr2O7溶液,恰好完全反应,则SnC12的浓度为(提示:①2Fe3++Sn2+═2Fe2++Sn4+;②6Fe2++Cr2O${\;}_{7}^{2-}$+14H+═6Fe3++2Cr3++7H2O)( )| A. | 0.3000mol•L-1 | B. | 1.2000 mol•L-1 | C. | 0.0333mol•L-1 | D. | 0.1333 mol•L-1 |
分析 由信息可知,发生的反应为:2Fe3++Sn2+=Sn4++2Fe2+,6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,则存在Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,以此计算.
解答 解:由信息可知,发生的反应为:2Fe3++Sn2+=Sn4++2Fe2+,6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
存在Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,
设SnC12溶液浓度为x,则
Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,
1 $\frac{1}{3}$
ax $\frac{a}{2}$×0.2
$\frac{1}{ax}$=$\frac{\frac{1}{3}}{\frac{a}{2}×0.2}$,
解得:x=0.3000 mol/L,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列反应属于加成反应的是( )
| A. | CH2=CH2+H-OH$\stackrel{催化剂}{→}$ CH3CH2OH | |
| B. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$ 2HCl | |
| C. | CH3CH2Br+KOH$→_{△}^{H_{2}O}$CH3CH2OH+KBr | |
| D. | CH3CH3+2Cl2 $\stackrel{光}{→}$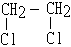 +2HCl +2HCl |
20.如图实验操作或装置(略去部分夹持仪器)正确的是( )
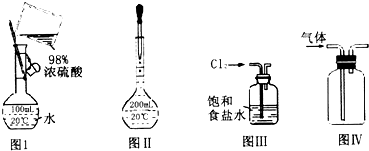

| A. | 图I表示为配制一定物质的量浓度稀硫酸时的操作 | |
| B. | 图Ⅱ表示为配制一定物质的量浓度的溶液定容时的操作 | |
| C. | 用图III所示装置吸收氯气中的氯化氢气体 | |
| D. | 用图IV所示装置收集一氧化氮气体 |
4.下列说法错误的是( )
| A. | 从1L1 mol•L-1的氯化钠溶液中取出10ml,其浓度仍是1mol•L-1 | |
| B. | 配制0.5L 10 mol•L-1的盐酸,需要氯化氢气体112L(标准状况) | |
| C. | 0.5 L 2 mol•L-1的氯化钡溶液中,钡离子和氯离子总数为1.806×1024 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与10mL18.4 mol•L-1硫酸的浓度是不同的 |
14.已知外电路中,电子由铜流向a极.有关图中装置分析合理的一项是( )
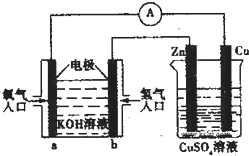

| A. | 一段时间后锌片质量减少 | |
| B. | 该装之中Cu极为正极 | |
| C. | b极的电极反应式:H2-2e-═2H+ | |
| D. | 当铜片的质量变化为12.8g时,a极上消耗的 O2在标况下的体积为2.24L |
1.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 在常温常压下,11.2L N2含有的分子数为NA | |
| B. | 标准状况下,18g H2O所占的体积约是22.4L | |
| C. | 32gO2在标准状况下所占的体积约为22.4L | |
| D. | 1mol Ne中约含有6.02×1024个电子 |
18.X、Y、Z三种物质中含同种元素,在一定条件下可以实现如图所示转化,下列推断不正确的是( )
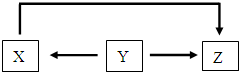

| A. | 若Y为氧化铝,则Y 生成X的条件是“通电” | |
| B. | 若X为硫单质,则Y 可能为硫化氢 | |
| C. | 若Z为硝酸,则X可能为一氧化氮 | |
| D. | 若Z为硝酸铁,则Y一定为铁单质 |
19.报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
| A. | N4和N2是互为同位素 | |
| B. | N4的摩尔质量是56g | |
| C. | 相同质量的N4和N2所含原子个数比为2:1 | |
| D. | 每个N4分子含有28个电子 |

 .
.